この記事では2019年9月末から話題になっているラニチジン製剤の自主回収問題についてまとめます。
各薬局での自主回収の対応の一助となればいいなという思いと、覚書としての意味でまとめます。
今後、情報が入り次第、随時更新を行なっていきます。
- 1 ラニチジン製剤の自主回収
- 2 詳しい経緯と各社の対応状況
- 2.1 ラニチジン製剤へのNDMA混入発覚から自主回収までの経緯
- 2.1.1 9/13 EMA・FDAプレスリリース
- 2.1.2 9/17 厚生労働省 事務連絡
- 2.1.3 9/18〜9/20 各社ラニチジン製剤を出荷停止
- 2.1.4 9/26 GSK クラスⅡ自主回収 開始
- 2.1.5 10/2 日医工 クラスⅡ自主回収 開始
- 2.1.6 10/3 沢井・武田テバ・マイラン・ニプロ・東和薬品・鶴原・小林化工 クラスⅠ自主回収 開始
- 2.1.7 10/4 陽進堂・日本ジェネリック クラスⅠ自主回収 開始
- 2.1.8 10/8 日医工 クラスⅡ自主回収をクラスⅠに切り替え
- 2.1.9 10/9 GSK クラスⅡ自主回収をクラスⅠに切り替え
- 2.1.10 10/10 GSK・武田テバ 自主回収を患者手持ち分まで拡大・費用負担を発表
- 2.1.11 10/15 日医工・沢井製薬・マイラン(ファイザー)・東和薬品・鶴原製薬(ニプロ)・小林化工・陽進堂(第一三共)・日本ジェネリック 自主回収を患者手持ち分まで拡大・費用負担を発表
- 2.1.12 2021年7月追記 ラニチジン製剤は各社ともに製造中止に・・・
- 2.2 各社の費用負担について(まとめ)
- 2.1 ラニチジン製剤へのNDMA混入発覚から自主回収までの経緯
- 3 まとめ・雑感
ラニチジン製剤の自主回収
当初はザンタックの自主回収(クラスⅡ)で始まったこの問題。
その後、ジェネリックを製造しているメーカーも自主回収を開始し・・・。
最終的には全メーカーがクラスⅠでの自主回収を行なっている状態です。
2019年度クラスⅠ(医薬品)
今回の回収についてはすべてのメーカーが患者さんからの回収も含めた自主回収を行うことを発表しており、それに伴う費用負担を行うことも決定しています。
なぜ自主回収が行われるの?
今回の自主回収の原因はN-ニトロソジメチルアミン(NDMA*1、C2H6N2O)という物質の混入です。

NDMAはWHOをはじめとする多くの研究機関で発癌性物質として位置付けられています。
主要機関でのNDMAの位置付け
| 機関(年) | 分類 | |
|---|---|---|
| WHO*2 | IARC*3(1987) | 2A ヒトに対して恐らく発がん性がある。 |
| EU*4 | (2004) | 2 ヒトに対して発がん性であるとみなされるべき物質。 |
| USA*5 | NTP*6(2005) | 合理的にヒトに対して発がん性のあることが懸念される物質。 |
| ドイツ | DFG*7(2004) | 2 動物の発がん性物質であり、 ヒトの発がん性物質でもあると考えられる。 |
NDMAとはどんな物質なのか?
NDMAはニトロソアミンと呼ばれる化合物の一種で、その中でも最も単純な構造を持っています。
ニトロソアミンはアミン類のアミン窒素上の水素がニトロソ基に置き換わったもので、酸性下で2級アミンと亜硝酸が反応することで容易に生成されます。
発癌性物質と聞くと摂取することなんてあり得ないと思ってしまうかもしれませんが、ニトロソアミンは一般的な生活の中でも摂取している物質です。
ニトロソアミンの元になる2級アミンは空気中や食品に普通に存在し、亜硝酸塩も食品添加物として広く使用されています。
ですので、ニトロソアミンは大気中や水、タバコなどに含まれていることが知られていますし、加工肉や燻製肉に比較的多く存在することが知られています。
生活習慣によって暴露されている量は異なるかもしれませんが、ニトロソアミンは普通に生活しているうちに接している可能性が高い発癌性物質ということが言えます。
どうしてNDMAが混入した?
今回、全てのラニチジン製剤が自主回収を行なっています。
後にまとめますが、全てのラニチジン製剤からNDMAが検出されたわけではありませんが、検出されていないものでも混入の可能性が否定できないため自主回収となっています。
これはラニチジンの構造に原因があります。

まずはラニチジンの構造のうち、下の赤丸を囲った部分を見てください。
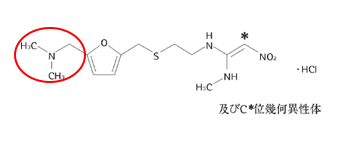
そして次の画像がNDMAの構造です。

とても似ていることが分かりますね。
このように類似部分が存在するため、ラニチジンの合成過程でNDMAが副産物として生成されてしまうことが今回のNDMA混入の原因ではないかと考えられるようです。
これがある以上、ラニチジンの合成過程でNDMAが発生するリスクを完全に除去することは困難なのではないかと想像されます。
ただ、合成の過程でNDMAが発生したという結論はまだ出ていません。
どこかの段階で混入した可能性も否定できません。
現在はすべての可能性を想定して原因を調査している段階です。
ラニチジン製剤の服用=発がんリスク上昇なのか?
ラニチジン製剤に発癌物質であるNDMAが含まれていたのなら、ラニチジン製剤を服用していた人の発がんリスクは上昇するのか?
これに関しての詳しいデータは存在しませんが、現段階ではその可能性は低いのではないかと個人的には考えています。
その理由の一つは、「管理水準(0.32ppm)を上回る量=発がん性リスクを高める量」とは限らないため。
もう一つは、GSKの公表内容にあるように「ザンタック錠の服用と発がん性との関連が確認されていない」ためです。
今回の対応(クラスⅠ 自主回収)はあくまでも社会的情勢を踏まえた予防的措置と言えます。
もちろん、今後の試験やデータ解析により悪い結果が出ることは否定できませんが、現時点で過剰な心配をする必要はないのではないかと考えています。
詳しい経緯と各社の対応状況
ここからはもう少し詳しく状況をまとめていきたいと思います。
ラニチジン製剤へのNDMA混入発覚から自主回収までの経緯
簡単にまとめると以下のような流れです。
- 2019.9.13 EMA・FDA プレスリリース(ラニチジン製剤の一部にNDMAが混入している可能性があるため調査開始)
- EMA「EMA to review ranitidine medicines following detection of NDMA」
- FDA「Statement alerting patients and health care professionals of NDMA found in samples of ranitidine」
- 2019.9.17 厚生労働省 EMA・FDAのプレスリリースを受けて日本国内のラニチジン製剤販売メーカーに一時販売停止と調査の実施を事務連絡(ラニチジン塩酸塩における発がん物質の検出に対する対応について)
- 2019.9.26 GSK ザンタック錠/注射液の自主回収開始(クラスⅡ)
- 2019.10.2 日医工 ラニチジン錠「日医工」の自主回収開始(クラスⅡ)
- 2019.10.3 沢井製薬・武田テバ・マイラン(ファイザー)・ニプロ・東和薬品・鶴原製薬・小林化工 ラニチジン製剤の自主回収開始(クラスⅠ)
- 2019.10.4 陽進堂(第一三共エスファ)・日本ジェネリック ラニチジン製剤の自主回収開始(クラスⅠ)
- 2019.10.8 日医工 ラニチジン錠「日医工」の自主回収をクラスⅡからクラスⅠに切り替え
- 2019.10.9 GSK ザンタック錠/注射液の自主回収をクラスⅡからクラスⅠに切り替え
- 2019.10.10 GSK・武田テバ 自主回収を患者手持ち分まで拡大、それに伴う費用負担を発表
- 2019.10.15 全社 自主回収を患者手持ち分まで拡大、それに伴う費用負担を発表
- 〜2021.7 先発品を含むラニチジン製剤のほとんどの製造中止を発表される
9/13 EMA・FDAプレスリリース
9/13付の欧州医薬品庁(EMA*8)・米国食品医薬品局(FDA*9)のプレスリリースについてリンクを貼っておきます。
いずれも一部のラニチジン製剤からNDMAが検出されたことを受け、調査を開始することについて記載されています。
9/17 厚生労働省 事務連絡
EMAとFDAのプレスリリースを受け、厚生労働省も調査を開始します。
9/17付でラニチジン製剤を販売しているメーカーに対しNDMAの含有についての調査を行うよう指示を出し、問題ないという結果が出るまでは出荷停止を行うよう事務連絡を出しました。
9/18〜9/20 各社ラニチジン製剤を出荷停止
この連絡を受け、9/18 or 9/19付でラニチジン製剤を販売する各社がラニチジン製剤の出荷停止を実施。
- ラニチジン錠75mg「日医工」ラニチジン錠150mg「日医工」 一時出荷停止について
- ラニチジン錠75mg/150mg「サワイ」出荷停止のお詫びとお知らせ
- H2受容体拮抗剤『ラニチジン錠75mg・150mg「タイヨー」/ラニチジン注射液50mg・100mg「タイヨー」』 出荷停止のお知らせ
- ラニチジン製剤「NP」/「ツルハラ」 一時出荷停止のご連絡とお詫び
- ラニチジン錠75mg/150mg「トーワ」 出荷停止に関するお詫びとお知らせ
- ラニチジン錠75mg/150mg「ツルハラ」の出荷停止のお詫びとお知らせ
- ラニチジン錠75・150「KN」の出荷一時停止のお知らせ
- ラニチジン錠75mg/150mg「YD」出荷停止のお詫びとお知らせ
9/26 GSK クラスⅡ自主回収 開始
9/26付でグラクソスミスクライン(GSK*10)がクラスⅡの自主回収を開始しました。
現在、日本におけるザンタックの原薬並びに製剤については、実際にNDMAが混入しているのかどうかについて調査並びに分析を実施中の段階ではありますが、上記の世界的情勢を鑑み、弊社といたしまして、予防的措置として、通告を受けた製造委託先の原薬を用いた製品について自主的な回収を行うことを決定いたしました。なお、ラニチジンの安全性監視活動は定期的に行っていますが、これまでに発がん性を示唆する事象は認められていません。(2019年9月時点)
引用元:H2受容体拮抗剤「ザンタック錠75」「ザンタック錠150」「ザンタック注射液50mg」「ザンタック注射液100mg」の自主回収(クラスII)のお詫びとお知らせ
10/2 日医工 クラスⅡ自主回収 開始
遅れること約1週間、10/2付で日医工もクラスⅡの自主回収を開始しました。
海外に於いて原薬ラニチジン塩酸塩を使用した製剤から発がん性物質であるN-ニトロソジメチルアミン(以下、NDMAという)が検出されたとの措置報告を入手し、現在、本製品及び本製品に使用しています原薬ラニチジン塩酸塩についてNDMAの分析を実施中ですが、NDMAの混入の可能性について否定することができないため、予防的な措置として、別紙の対象ロットについて自主回収することと致しました。
この度の回収は、あくまで予防的な回収であり、現在までのところ本件による重篤な健康被害等に関する報告は受けておりません。引用元:H2受容体拮抗剤ラニチジン錠75mg「日医工」ラニチジン錠150mg「日医工」 自主回収に関するお知らせとお願い
また本剤においては、安定供給の目的から原薬複数化によりセカンドソースを保有しておりましたが、海外の報告にあった同メーカーの原薬であったことから使用しておりません。同メーカーの原薬を使用した本剤の市場在庫はございません。
10/3 沢井・武田テバ・マイラン・ニプロ・東和薬品・鶴原・小林化工 クラスⅠ自主回収 開始
これに続く形 10/3付で、沢井製薬・武田テバ・マイラン製薬・ニプロ・東和薬品・鶴原製薬・小林化工の7社もラニチジン製剤の自主回収を発表しましたが、GSKと日医工とは異なりクラスⅠでの自主回収としました。
沢井製薬の自主回収案内
現在のところ、弊社のラニチジン塩酸塩の製剤及び原薬の製造工程でのNDMAの生成リスクは低いと考えております。また現時点では、NDMA は検出されておりませんが、収集した情報により混入リスクが完全に否定できないため、予防的措置として弊社のラニチジン製剤について自主回収することといたしました。
武田テバ(「タイヨー」)の自主回収案内
当該調査の結果、本製品に使用している原薬から管理水準を上回るNDMAが検出されため、有効期限内の全ロットについて自主回収することといたしました。
なお、本製品の安全性に関する社内データからは、これまでに発がん性を示唆する事象は認められておりません。引用元:自主回収(クラス I)のお知らせ H2受容体拮抗剤ラニチジン錠75mg・150mg「タイヨー」/ラニチジン注射液50mg・100mg「タイヨー」
- 自主回収(クラス I)のお知らせ H2受容体拮抗剤ラニチジン錠75mg・150mg「タイヨー」/ラニチジン注射液50mg・100mg「タイヨー」
- H2受容体拮抗剤ラニチジン錠75mg・150mg「タイヨー」/ラニチジン注射液50mg・100mg「タイヨー」製品回収に関するお詫びとお願い
- 患者さん向けご案内(ラニチジン錠75mg・150mg「タイヨー」)
- 患者さん向けご案内(ラニチジン注射液50mg・100mg「タイヨー」)
マイラン製薬(販売元:ファイザー製薬)の自主回収案内
この度、本製品の有効成分(原薬)におきまして、発がん性物質である N‐ニトロソジメチルアミンが管理指標を超えて検出されたことが判明したため、これら原薬が使用された使用期限内の本製品すべてを自主回収(クラスI)いたします。
【危惧される健康被害】
NDMAは発がん性物質であり、重篤な健康被害にいたる可能性は否定できませんが、これまでに発がん性を示唆する事象は認められていません。今後、発がん性を示唆する事象が認められた場合はすみやかに情報提供する予定です。
- ラニチジン錠75mg、同150mg「マイラン」自主回収(クラスⅠ)につきまして
- ラニチジン自主回収(クラスⅠ)につきまして
- ラニチジン錠75mg「マイラン」/ラニチジン錠150mg「マイラン」を服用されている患者様へ
ニプロ(「NP」)の自主回収案内
標題製剤および原薬の分析中ですが、現時点においてNDMAの混入の可能性が否定できないため、安全に万全を期すため自主回収することといたします。 なお、弊社製品の安全性に関する社内データからは、現在までのところ本件に関連する健康被害等の報告は受けておりません。
引用元:ラニチジン注50mg/100mgシリンジ「NP」 ラニチジン錠150mg「ツルハラ」 自主回収(クラスI)のお知らせ
- ラニチジン注50mg/100mgシリンジ「NP」 ラニチジン錠150mg「ツルハラ」 自主回収(クラスI)のお知らせ
- ラニチジン錠150mg「ツルハラ」 自主回収(クラスⅠ)のお知らせ
- ラニチジン錠150mg「ツルハラ」を服用される患者さんへ
東和薬品(「トーワ」)の自主回収案内
そして、当該調査の結果、本製品に使用している原薬から管理指標を上回るNDMAが検出されたため、有効期限内の全ロットについて自主回収することといたしました。
なお、本製品の安全性に関する社内データからは、これまでに発がん性を示唆する事象は認められておりません。
- H2受容体拮抗剤ラニチジン錠75mg「トーワ」、ラニチジン錠150mg「トーワ」(一般名:ラニチジン塩酸塩)自主回収(クラスI)に関するお知らせ
- 自主回収(クラスI)のお知らせ H2受容体拮抗剤 ラニチジン錠75mg/150mg「トーワ」
鶴原製薬(「ツルハラ」)の自主回収案内
さて、H2受容体拮抗剤 ラニチジン錠75mg「ツルハラ」・ラニチジン錠150mg「ツルハラ」につきまして、当該製品に使用している原薬から水準値(0.32ppm)を上回る N-ニトロソジメチルアミン(NDMA)が検出されたとの報告を原薬メーカーから受けました。当該物質は、WHOにおいてヒトに対しておそらく発がん性がある物質であると分類されており、NDMAの発がんリスクを完全に否定できないため、予防的措置として、有効期限内の全ロットについて自主回収(クラスI)することといたしました。なお、現在までのところ本件による重篤な健康被害等に関する報告は受けておりません。
引用元:H2受容体拮抗剤ラニチジン錠75mg「ツルハラ」・ラニチジン錠150mg「ツルハラ」 自主回収(クラスI)に関するお知らせ
小林化工(「KN」)の自主回収案内
そして、当該調査の結果、本製品に使用している原薬から管理水準を上回るNDMAが検出されたため、有効期限内の全ロットについて自主回収(クラスI)することといたしました。
なお、本製品の安全性に関する社内データからは、これまでに発がん性を示唆する事象は認められておりません。
10/4 陽進堂・日本ジェネリック クラスⅠ自主回収 開始
さらに10/4付で陽進堂と日本ジェネリックもクラスⅠでの自主回収を開始しました。
これでラニチジン製剤を販売しているメーカー(日本ジェネリックは販売中止、経過措置期間)は全て自主回収を開始したことになります。
陽進堂(「YD」、販売元:第一三共エスファ)の自主回収案内
これを受け、ラニチジン錠の原薬についてNDMAの分析を実施したところ、管理水準を超えたNDMAが検出されたため、有効期限内の全ロットについて自主回収することといたしました。
NDMAは発がん性物質であり、重篤な健康被害にいたる可能性は否定できませんが、これまでに発がん性を示唆する事象は認められていません。今後、発がん性を示唆する事象が認められた場合はすみやかに情報提供する予定です。
日本ジェネリック(「JG」、2018年10月1日に販売中止 案内済)の自主回収案内
弊社製品へのNDMA混入の可能性を調査した結果、原薬から管理水準をうわまわるNDMAが検出されたため、有効期限内の全ロットについて自主回収することといたしました。関係者の皆様に多大なご迷惑をお掛けする点、誠に申し訳なく、衷心より深くお詫び申しあげます。
なお、本製品の安全性に関する社内データからは、これまでに患者さまで発がん性を示唆する事象は認められておりません。
10/8 日医工 クラスⅡ自主回収をクラスⅠに切り替え
クラスⅡでの自主回収を開始していた日医工ですが、他社にならい、10/8付でクラスⅠへの自主回収に変更しています。
本剤につきましては、これまで予防的措置としてクラス II の自主回収を行って参りましたが、今般NDMAの混入が否定できないことから、回収のクラス分類をクラス I に変更いたします。なお、現在までのところ重篤な健康被害等に関する報告は受けておりません。
10/9 GSK クラスⅡ自主回収をクラスⅠに切り替え
最終的に、10/9付でGSKも自主回収をクラスⅡからクラスⅠに切り替えました。
これでラニチジン製剤は全てクラスⅠでの自主回収が実施されることとなりました。
ラニチジン塩酸塩を原薬とするこれら製剤については、海外当局より発がん性物質N-ニトロソジメチルアミン(NDMA)が検出されたとの報告を受け、9月19日より弊社から出荷を停止いたしました。その後、自主的な回収(クラスII)を行いました。現在、ザンタック製剤を使用し続けることを裏付ける国内におけるデータについて調査中ではありますが、協議の結果、予防的措置として回収分類を変更し、本日よりクラスIでの回収を行うことといたしました。
なお弊社のザンタックの安全性については、非臨床情報、公表文献、及び弊社が入手している臨床安全性情報を含め、すべての情報を包括的にレビューしています。これらの情報には、1981年以降に収集した臨床試験成績及び自発報告症例が含まれており、安全性監視活動は定期的に行っていますが、これまでに発がん性を示唆する事象は認められていません。(2019年9月時点)引用元:H2受容体拮抗剤「ザンタック錠75」「ザンタック錠150」「ザンタック注射液50mg」「ザンタック注射液100 mg」の自主回収(クラスI)につきましてのお詫びとお知らせ
10/10 GSK・武田テバ 自主回収を患者手持ち分まで拡大・費用負担を発表
10/10付でGSKと武田テバは自主回収の範囲をすでに投薬済みの患者手持ち分まで拡大し、それにかかる費用を負担することを発表しました。
これについては、10/9付で厚生労働省医政局経済課からラニチジン製造販売元メーカー各社に対し、代替薬に切り替える際の費用負担についての連絡に基づいて実施されるようです。
おそらく連休明け(10/15)には他の各社も同様の対応を発表すると思います。
ただし、費用負担については各社で微妙に異なる可能性があります。(すでにGSKと武田テバで微妙に異なります)
患者さんにスムーズに対応してもらうために、該当する薬剤を販売しているメーカーの対応について把握しておく必要がありますね。
GSKの自主回収範囲拡大と費用負担対応
まずは患者様からの回収も含めた自主回収について。
この度、弊社が製造販売する H2受容体拮抗剤「ザンタック錠75」「ザンタック錠150」「ザンタック注射液50mg」「ザンタック注射液100mg」(一般名:ラニチジン塩酸塩)について、10月9日よりクラスI分類へ変更し、全ロットを対象として患者様からも含めた製品の自主的回収を行うことを決定いたしました。
引用元:H2受容体拮抗剤「ザンタック錠75」「ザンタック錠150」「ザンタック注射液50mg」「ザンタック注射液100mg」の自主回収(クラスI)につきましてのお詫びとお知らせ
- H2受容体拮抗剤「ザンタック錠75」「ザンタック錠150」「ザンタック注射液50mg」「ザンタック注射液100 mg」の自主回収(クラスI)につきましてのお詫びとお知らせ
- 「ザンタック錠 75」「ザンタック錠 150」を服用されている患者さまへ
治療薬変更に伴う患者様の負担額精算に関して必要な事項は以下の通りです。
【対象】
患者様が服用を終える前のザンタック錠を代替薬に切り替えるために医療機関を受診した際に生じた費用【弊社が負担させていただく費用項目*】
- 代替薬剤費
- 代替薬剤処方のための再診費
- 代替薬剤処方のために発生した交通費(一律三千円)
*上記の費用は保険外の取り扱いとさせていただきます。
なお、患者様からのザンタック錠の返品(残薬)に対する返金は致しかねますので、ご容赦ください。【ご協力いただきたい内容】
- 患者様から求めがあった場合には、代替薬の領収証にザンタック錠の代替処方である旨を記載いただき、薬剤師または医師の印鑑を押していただければと思います。その領収証と処方薬剤の明細書のコピーを証左として、 患者様の費用を負担させていただきます。
- 具体的な精算手順に関するお問合せにつきましては、下記のザンタック錠患者様費用負担専用ダイアルへお電話いただくよう、患者様へお伝えください(10月15日より受付を開始致します)。
TEL:0120-343-775(9:00〜17:45/土日祝日および当社休業日を除く)
【具体的な清算手順】
- 患者様ご自身で、上記フリーダイアルへお電話いただき、精算手順を確認いただきます
- ザンタック錠患者様費用負担専用窓口より、必要書類を患者様へ郵送致します
- 同封の振込口座確認書に必要事項をご記入の上、下記の必要書類を封入し、返送いただきます
- 弊社より患者様の振込口座へお振込みさせていただきます
【必要書類】
- 診察代の領収証
- 代替薬剤の領収証(但し書き「ザンタックの代替処方」と薬剤師または医師のご捺印が必要です)
- 処方薬剤の明細書のコピー
武田テバ「タイヨー」の自主回収範囲拡大と費用負担対応
【追記】
10月9日、厚生労働省医政局経済課からラニチジン製造販売元メーカー各社に対し、代替薬に切り替える際の費用負担についての連絡がありました。同省からの連絡内容を踏まえ、代替薬に切り替える際に生じた諸費用(医療機関における再診料、処方箋料等、薬局における調剤料、薬剤料等)につきましては、弊社が負担することとなります。そのため、当該諸費用につきましては、自由診療でのご対応をお願いいたします。なお、当該諸費用の支払い対応につきましては、お手数ですが、弊社の「武田テバ ラニチジン錠・注「タイヨー」 専用ダイヤル」までお問い合わせ頂きますようお願い申し上げます。引用元:H2受容体拮抗剤『ラニチジン錠75mg・150mg「タイヨー」/ラニチジン注射液50mg・100mg「タイヨー」』 自主回収(クラスI)に関するお知らせ【追記】
【対象】
患者さまが服用を終える前のラニチジン錠75mg・150mg「タイヨー」を代替薬に切り替えるために医療機関を受診した際に生じた諸費用【弊社が負担させていただく諸費用】
- 代替薬剤費
- 代替薬剤処方のための再診料
- 代替薬剤処方のために発生した交通費(実費)
※上記費用は保険外での取り扱いとさせていただきます。
なお、ラニチジン錠75mg・150mg「タイヨー」の返品(残薬)に対する返金はいたしかねますので、ご容赦ください。【ご協力いただきたい内容】
- 患者さまからの求めがあった場合には、代替薬の領収書に『武田テバ代替品』と、ご記載いただき医師あるいは薬剤師の捺印をお願いいたします。その領収書と処方薬剤の明細書のコピーを証左として、患者さまの費用を負担させていただきます。
- 具体的な精算手順に関するお問い合わせにつきましては、下記、『武田テバ ラニチジン錠・注「タイヨー」専用ダイヤル』へお電話いただくよう、患者さまへお伝えください。
【具体的な精算手順】
- 患者さまご自身で、『武田テバ ラニチジン錠・注「タイヨー」 専用ダイヤル』へお電話いただきます。
- 『武田テバ ラニチジン錠・注「タイヨー」 専用ダイヤル』より必要書類を患者さまへ送付いたします。
- 同封の『代替薬剤処方費用請求書』に必要事項を記入の上、下記の必要書類を封入し、返送いただきます。
- 弊社より患者さまの振込口座へお振込みをさせていただきます。
※お支払いにつきましては、必要書類の弊社到着後、1 か月程度のお時間をいただきます。
【必要書類】
- 診察代の領収書
- 代替薬剤の領収書(但し書き『武田テバ代替品』と記載いただき医師または薬剤師のご捺印が必要になります)
- 処方薬剤の明細書コピー
- 代替薬剤処方のために発生した交通費の領収書(タクシー・新幹線等)
※電車やバスなどの公共交通機関による少額交通費の場合、領収書は不要です。
【本件に関するお問い合わせ】
武田テバ ラニチジン錠・注「タイヨー」 専用ダイヤル TEL:0120-848-281
受付時間 9:00~17:30(土日祝日・弊社休業日を除く)引用元:H2受容体拮抗剤『ラニチジン錠75mg・150mg「タイヨー」』を服用されている患者さまへの治療薬変更に伴う患者さまの負担額精算に関して
GSKは交通費が一律3,000円でしたが、武田テバは実費となっていますね。
また、武田テバは患者さん用にフローまで作成しており、分かりやすくなっています。
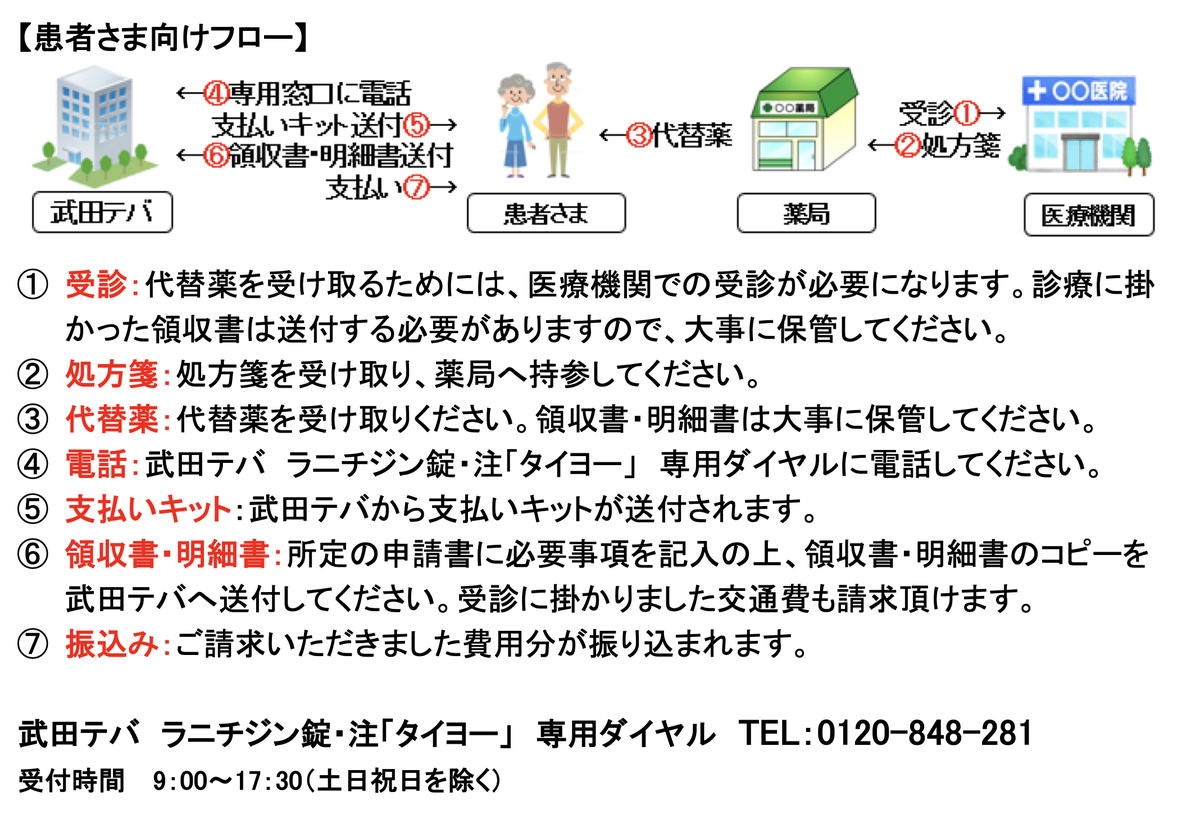
10/15 日医工・沢井製薬・マイラン(ファイザー)・東和薬品・鶴原製薬(ニプロ)・小林化工・陽進堂(第一三共)・日本ジェネリック 自主回収を患者手持ち分まで拡大・費用負担を発表
各メーカーの対応は基本的に同じなのでリンクのみ掲載します。(後にまとめます)
日医工の自主回収範囲拡大と費用負担対応
沢井製薬「サワイ」の自主回収範囲拡大と費用負担対応
マイラン(ファイザー)の自主回収範囲拡大と費用負担対応
東和薬品「トーワ」の自主回収範囲拡大と費用負担対応
鶴原製薬「ツルハラ」の自主回収範囲拡大と費用負担対応
ニプロ「ツルハラ」の自主回収範囲拡大と費用負担対応
小林化工「KN」の自主回収範囲拡大と費用負担対応
陽進堂「YD」の自主回収範囲拡大と費用負担対応
第一三共エスファ「YD」の自主回収範囲拡大と費用負担対応
日本ジェネリック「JG」の自主回収範囲拡大と費用負担対応
2021年7月追記 ラニチジン製剤は各社ともに製造中止に・・・
- 小林化工:2020年7月 ラニチジン錠150「KN」:販売中止のご案内
- 全星薬品工業:2020年8月 販売中止のご案内 ラニチジン錠150「KN」
- 陽進堂:2020年12月 ラニチジン錠75mg「YD」 ラニチジン錠150mg「YD」 製造販売中止のご案内
- 日医工:2021年1月 ラニチジン錠75mg /150mg「日医工」 販売中止のご案内
- 東和薬品:2021年2月 ラニチジン錠 75mg/150mg「トーワ」 販売中止のお知らせ
- 沢井製薬:2021年3月 ラニチジン錠 75mg/150mg「サワイ」 販売中止のお知らせ
- 鶴原製薬:2021年3月 ラニチジン錠 75mg/150mg「ツルハラ」販売中止のご案内
- マイラン製薬:2021年5月 販売中止予定のご案内 ラニチジン錠75mg「マイラン」 ラニチジン錠150mg「マイラン」
- グラクソ・スミスクライン:2021年7月1日 弊社製品の販売中止についてのお知らせ
- 武田テバファーマ:ラニチジン錠75mg・150mg ・注射液50mg・100mg「タイヨー」 販売終了のお知らせ
※日本ジェネリックは2018年10月に販売中止を決定済み(販売中止・経過措置期間中の自主回収でした)
2021年7月に先発医薬品であるザンタック錠/注射液の製造中止が発表され、ラニチジン製剤のほとんどが製造中止となりました。
なぜか、ラニチジン注50mg/150mgシリンジ「NP」については製造中止の案内が出ていませんが、時間の問題かもしれません。
各社の費用負担について(まとめ)
2019.10.15付で全メーカーが患者さんの手持ち分までの自主回収を行い、その費用負担を行うことが決定しました。
その内容について整理します。
対象費用
各メーカーが負担するのは以下の費用です。
- 代替薬剤費
- 代替薬剤処方のための再診費
- 代替薬剤処方のために発生した交通費(一律三千円 ※武田テバは実費)
当然、保険外診療となるので上記が自費で計算され、その分が支払われる形になります。
交通費に関しては武田テバのみが実費を請求可能で、その他のメーカーは一律3千円になっています。
マイランのみですが、医療機関が要した以下の費用についても負担してくれます。
【医療関係者様】ラニチジン錠「マイラン」の治療変更に伴う費用精算に関して
- 代替薬剤処方のための再診費(医療機関が立て替えた場合)
- 代替薬剤処方のために発生した交通費
- 対象となる患者様にご連絡した際の電話代、郵便代等
医療機関が必要とする交通費というのがどのようなケースか分かりにくいですが、自宅まで自主回収に行く場合だろうと思います。
精算手順
費用負担を行なってもらうための手順は以下のようになっており、患者さん自身に行なってもらう必要があります。
- 各メーカーの対応窓口に電話(番号は各社の案内に記載あり)
- 手順の説明を受ける
- メーカーから患者さん宅に精算に必要な書類が送付される
- 支払依頼書に必要事項を記入
- 支払依頼書と必要事項を返送
- メーカーから患者さんの口座に費用が振り込まれる
マイランが行う医療機関に対する費用負担の流れも同じです。
必要書類
費用負担の請求に必要な書類は以下のようになっています。
- 診療費の領収証※1
- 但し書き「○○○(薬剤名)の代替処方」
- 医師の捺印
- 代替薬剤調剤費の領収証
- 但し書き「○○○(薬剤名)の代替処方」
- 医師または薬剤師の捺印
- 代替処方薬剤の明細書のコピー
※1:GSK(ザンタック)と第一三共エスファ(「YD」)は診療費の領収証に関する但書・捺印の指示なし(同じ「YD」でも陽進堂は指示あり)
※2:武田テバは代替薬剤処方のために発生した交通費の領収書(タクシー・新幹線等)も必要(電車やバスなどの公共交通機関による少額交通費の場合、領収書は不要)
マイランが行う医療機関に対する費用負担で必要となる書類は以下の通りです。
- 再診費用の明細(*医療機関が再診費用等を立て替えた場合)
- 交通費、文書送付費用に関する領収書
患者さんが受診する前に情報提供を!
今回の費用負担ですが、基本的には(マイラン以外は)患者さんが自費で一度払ったものをメーカーが後から負担する形になっています。
一度、実費で負担してもらう必要があることをしっかり説明しておかないとトラブルになりそうですね・・・。
また、それに伴い必要な書類等もあるので、医療機関と患者さんに受診の際の説明を行う必要がありますね。
一時的とは言え自費での費用負担と受診のための時間を割いてもらう必要があるので、スムーズに対応できるような説明が大切になると思います。
まとめ・雑感
今回の件で思ったことを雑多にまとめてみます。
すべてのメーカーの製品からNDMAが検出されたの?
それが現段階ではすべてのメーカーの製品から検出されているわけではないんですよね・・・
| 製品名 | 販売会社 | NDMA |
|---|---|---|
| ザンタック錠 | GSK | 未確認 |
| ラニチジン錠「日医工」 | 日医工 | 未確認 |
| ラニチジン錠「サワイ」 | 沢井製薬 | 未確認 |
| ラニチジン錠「タイヨー」 ラニチジン錠注射液「タイヨー」 | 武田テバ | 検出 |
| ラニチジン錠「マイラン」 | ファイザー製薬 | 検出 |
| ラニチジン注「NP」 | ニプロ | 未確認 |
| ラニチジン錠「ツルハラ」 | 鶴原製薬 ニプロ | 検出 |
| ラニチジン錠「トーワ」 | 東和薬品 | 検出 |
| ラニチジン錠「KN」 | 小林化工 | 検出 |
| ラニチジン錠「YD」 | 陽進堂 第一三共エスファ | 検出 |
| ラニチジン錠「JG」 | 日本ジェネリック | 検出 |
2019.10.29追記
令和元年度第9回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会の中でラニチジン製剤に関する対応についての経緯がまとめられています。(資料4-1 ラニチジン塩酸塩における発がん物質の検出に対する対応について)
きっとラニチジン製剤は販売中止に・・・
おそらくですが、ラニチジン製剤はこのまま販売中止に向かっていくんでしょうね。
構造的に合成過程でNDMAが生成されるリスクを0にするのは難しいようですし、H2blocker自体が代替薬も多く存在することから、ラニチジン製剤じゃないとダメだというケースがほとんどありません。
対応するコストやリスクを考えると販売中止はやむを得ないでしょう。
2021年7月 先発品のザンタック(GSK)を含むほぼ全てのラニチジン製剤の製造中止が発表されました。
NDMAの混入については医薬品製造の大きな課題に
NDMAの混入といえばARBに関する自主回収が記憶に新しいです。
- 2019/02/08付:アムバロ配合錠「ファイザー」 自主回収(クラスⅠ)
- 2018/07/06付:バルサルタン錠「AA」
この時も世界的に大きな問題となりました。
また、EMAはピオグリタゾンにもNDMAが含まれている可能性があるとプレスリリースを出しています。
EMA to provide guidance on avoiding nitrosamines in human medicines
今後、合成経路的にニトロソアミンを生成してしまう可能性のある薬剤についての調査が広がっていくでしょうし、メーカーはニトロソアミンが生成され内容な厳密な製造方法を求められていくのだと思います。
医療機関の負担も大きいのでは?
今回の自主回収はクラスⅠとなったこともあり、患者さんに渡してしまった薬剤についても自主回収の対象となります。
また、それに伴う費用負担もあるため、手続きがかなり煩雑になっています。
これって、処方量によっては対応する薬局や医療機関もかなり大変ですよね。
費用負担には医療機関・医療従事者側のコストは含まれていないようですね・・・。
また、今回の対応は自費での対応となりますが、その受診の際に通常の診断も受けるとかなったら混合診療となってしまうんでしょうか?
そのあたりの対応も含めてなかなか難しい点もあると思います。
対応が必要な薬局・医院の方々については大変かと思います。(うちの薬局ではラニチジン製剤の扱いはないんです・・・)
ニザチジン製剤についても調査中
今回のラニチジン製剤の自主回収はニザチジン製剤にも広がる可能性があります。
ラニチジンと構造が類似しているニザチジンについてもNDMAが混入していないかすでに調査に入っています。
ラニチジン塩酸塩における発がん物質の検出に対する対応について(事務連絡 令和元年9月17日)
これを踏まえ、ラニチジン塩酸塩又はラニチジンと類似の化学構造を有するニザチジンを製造販売する事業者においては、下記のとおり対応いただくよう お願いいたします。
1. 製造販売するラニチジン塩酸塩及びニザチジンについて、有効期限内の製品に使用されている原薬の製造所ごとに、製造工程における亜硝酸又は亜硝酸塩の混入リスクの有無及びその根拠並びに2.で実施する分析結果が得られる時期の目処を9月30日までに、厚生労働省医薬・生活衛生局監視指導・ 麻薬対策課宛て報告すること。
3. ラニチジン塩酸塩については、2.の分析結果が明らかになるまで、当該製品の新たな出荷は行わないこと。ただし、ニザチジンについてはこの限りでない。なお、2.の分析結果が明らかになるまでの間、NDMAの混入リスク等を示唆するその他の根拠がない限り、すでに市場に流通している製品の回収を行う必要はないこと。引用元:https://www.pmda.go.jp/files/000231528.pdf
ニザチジン製剤(アシノン®︎ 等)についてはどのような結果が出るのかこちらも注意を払っておきたいですね。
2019.10.23追記:ニザチジンカプセル「オーハラ」の自主回収(クラスⅠ)が開始されました。
大切な対応ですが過敏になりすぎないように・・・
こういった自主回収の際に大切なのは患者さんが過剰に不安にならないようにすることです。
NDMAという発がん性が示唆される物質の混入だけに安全性を重視した対応となっていますが、だからと言って服用=有害事象の発生というわけではありません。
有害事象が起こるかどうかについてはまだ検討されている段階で、現段階ではそのような報告はありません。
海外の報告によると検出されたNDMAは数ppm程度ということなので、どの程度の量が検出されたか気になりますね。
文章や対応から察するに大幅に限度値(0.32ppm)を上回ったわけではないとは思いますが・・・。
確実な回収は大切ですが、その際に患者さんを不安にさせてしまわないように、しっかりと理解して対応することが大切ですね。
バルサルタンはどうだった?
ちなみにNDMAが混入したバルサルタンを服用した患者さんにおいてどの程度の発がんリスクがあるか調査した論文があります。
Use of N-nitrosodimethylamine (NDMA) contaminated valsartan products and risk of cancer: Danish nationwide cohort study.(BMJ. 2018 Sep 12;362:k3851. PMID:30209057)
結果はNDMAの混入による癌の発生率に有意差はないというものになっていますが、条件等が揃っているわけではないのでなんとも言えないものがあります。
ただ、少なくとも、服用により明確に発がんリスクを高めることはないと言えるのではないかと思います。
*1:N-NitrosoDiMethylAmine
*2:世界保健機関/World Health Organization
*3:国際がん研究機関/International Agency for Research on Cancer
*4:欧州連合/European Union
*5:アメリカ合衆国/United States of America
*6:米国国家毒性プログラム/National Toxicology Program
*7:ドイツ研究振興協会/Deutsche ForschungsGemeinschaft
*8:European Medicines Agency
*9:Food and Drug Administration
*10:GlaxoSmithKline









