個人的には薬局では扱う機会がない抗HIV薬。
薬局で働く薬剤師としてはなかなか知識のアップデートが進まない分野ではありますが、患者さんが来局すればそんな言い訳はできません。
いつ処方箋を受け付けてもいいように普段から知識を身につけておくことが大切です。
もちろん、普段扱っている薬のようにはいかないかもしれませんが、常日頃からの勉強が対応時のベースを築いてくれると思います。
この記事ではHIVに関する基礎知識と抗HIV薬の分類、作用機序についてまとめたいと思います。
HIVってどんなウイルス?
HIV*1はヒト免疫不全ウイルスの略です。
免疫細胞を宿主として増殖し、最終的には感染した生物の免疫系を破壊していきます。
HIVによる感染症が重症化し、免疫機能が著しく低下してしまった病態を後天性免疫不全症候群(AIDS*2)と呼びます。
一般にはあまり知られていないのではないかと思うのですが、HIVにはHIV-1とHIV-2が存在します。
この分類はウイルスの塩基配列の違いによるものですが、先祖となったウイルスが異なると考えられています。
さらに、HIV-1も塩基配列によって4つのグループに分けられます。
- HIV-1
- Group M(Major)
- Group O(Outlier)
- Group N(non-M/non-O)
- Group P(pending)
- HIV-2
※Group M(Major)はさらに10のサブタイプ、15種類に分類
それぞれ感染者に地域性があり、日本ではHIV-1のGroup M(Major)がほとんどです。
HIV-2は西アフリカ地域に集中しており、日本での感染者は限られています。
HIVの構造
HIVはレトロウイルス科レンチウイルス属に属する直径100nmほどの球状のウイルスです。
エンベロープと呼ばれる膜にタンパク質でできたコア構造が包まれた構造になっています。
コア構造の中には2本のプラス鎖一本鎖RNA((+)ssRNA*3)が含まれます。(プラス鎖一本鎖RNAウイルス)
また、プロテアーゼ(PR*4)、逆転写酵素(RT*5)、インテグラーゼ(IN*6)などのウイルス酵素群も含まれています。

HIVが増殖する仕組み
HIVは人のCD4細胞(CD4陽性Tリンパ球やマクロファージ)を宿主細胞として感染します。
HIVは自身のみでは増殖することができず、宿主となるCD4細胞の増殖メカニズムを利用して(乗っ取って)増殖します。
その増殖メカニズムについて、以下の図の①〜⑩の流れで説明します。

- ①HIVのエンベロープ表面にはエンベロープスパイクと呼ばれる突起が存在します。この突起が細胞表面にある「CD4受容体」と補助受容体である「CCR5」や「CXCR4」と結合します。
- ②HIVと宿主細胞が融合し、HIVコア構造に含まれるRNAや酵素が宿主細胞の中に入っていきます。
- ③HIV逆転写酵素の働きによりHIV RNAがHIV DNAに逆転写されます。
- ④HIV DNAが宿主細胞の核内に侵入します。
- ⑤HIVインテグラーゼの働きにより宿主細胞のDNAが切断され、できた隙間にHIV DNAが組み込まれます。
- ⑥宿主細胞の酵素によりHIV DNAからmRNAが転写されます。
- ⑦HIV mRNAが宿主細胞の細胞質に移動します。
- ⑧HIV mRNAからタンパク質が翻訳されます。
- ⑨HIVプロテアーゼの働きにより、合成されたタンパク質が必要な形に分解されます。
- ⑩転写されたRNA、合成されたタンパク質から新たなHIVが作られ宿主細胞から放出されていきます。
このように、宿主となるCD4細胞を乗っ取り、免疫系を破壊しながら増殖していくのがHIVです。
HIVと耐性
免疫に関わる細胞を乗っ取ることで免疫系を破壊しながら増殖するだけでも厄介なHIVですが、さらに耐性化しやすいという特徴を持っています。
これはHIVがRNAウイルスであることに起因しています。
増殖メカニズムを見てもらえばわかるように、RNAウイルスであるHIVは宿主細胞に侵入したあと、自身を複製(コピー)するためにHIV RNAをHIV DNAに逆転写する過程を踏まなければなりません。
通常であれば「DNA→mRNA→タンパク質合成」という流れのところを「RNA→DNA→mRNA→タンパク質合成」とするため、転写反応が多くなります。
遺伝子の転写反応は完璧ではなく、一定の確率でエラーが生じてしまいます。
このような塩基配列の変化を変異と言います。
宿主細胞で増殖したHIVは次の宿主細胞を見つけるとまたそこに侵入します。
このように次々と複製を繰り返していくため、変異がどんどん起きて行きます。
さらに、DNAにはエラーが生じた場合に修復する機構が備わっていますが、RNAにはそれがありません。
このようにRNAウイルスであるHIVでは遺伝子情報がどんどん変化していく性質を持っています。
その結果、ウイルスやその酵素の構造などに変化が生じ、耐性の獲得につながっていくというわけです。
坑HIV薬一覧とその作用機序
ここからは抗HIV薬についてまとめていきたいと思います。
抗HIV薬はその作用機序によって以下の5種類に分類されます。
さらに新規作用機序の薬剤も開発中です。
- カプシド阻害剤(CAI*11)
HAART療法
HIV、特にHIV-1は突然変異を起こしやすいため、単独の薬剤で治療を行なっているとすぐに耐性を獲得してしまいます。
そこで、仮に耐性を獲得してしまってもすぐに倒せるように、作用点や耐性変異が異なる薬剤を複数組み合わせて処方が行われます。
これをHAART*12、ART*13(HAARTもARTも「T」がTherapyなので療法を付けずに呼ぶことが多いです)もしくはカクテル療法と呼びます。
複数の薬を組み合わせると耐性が出来にくいの?
複数の薬を組み合わせて使うと耐性が出来にくくなる?
同時に使うのではなくて耐性が出たら薬を変更するとした方が飲む量も減っていいんじゃないの?
そういう疑問を持つ方もいるかもしれません。
なのでもう少し詳しく説明しますね。
例として、Aという薬に1/10の割合で耐性を獲得するウイルスが存在するとします。
そのウイルスが10匹(匹であってるのかな?w)いるところにAを使うと1匹が生き残り、その後、Aに対する耐性を持つウイルスが増殖してしまいます。
そのウイルスがBという薬に対しては1/5の割合で耐性を獲得するとします。
同じようにそのウイルスが10匹いるところにBを使うと2匹が生き残ります。
じゃあ、AとBを同時に使うとどうでしょうか?
仮にAに対する耐性を獲得したとしてもそのウイルスはBに倒されます。
逆にBに対する耐性を獲得したとしてもAに倒されます。
耐性ウイルスが増殖するにはAとBの両方に対する耐性を同時に獲得する必要があります。
その確率は1/10×1/5=1/50
併用することで耐性を獲得する確率を大きく減らすことができるということがわかると思います。
(わかりやすくするために簡潔な例えにしているので詳細は異なります)
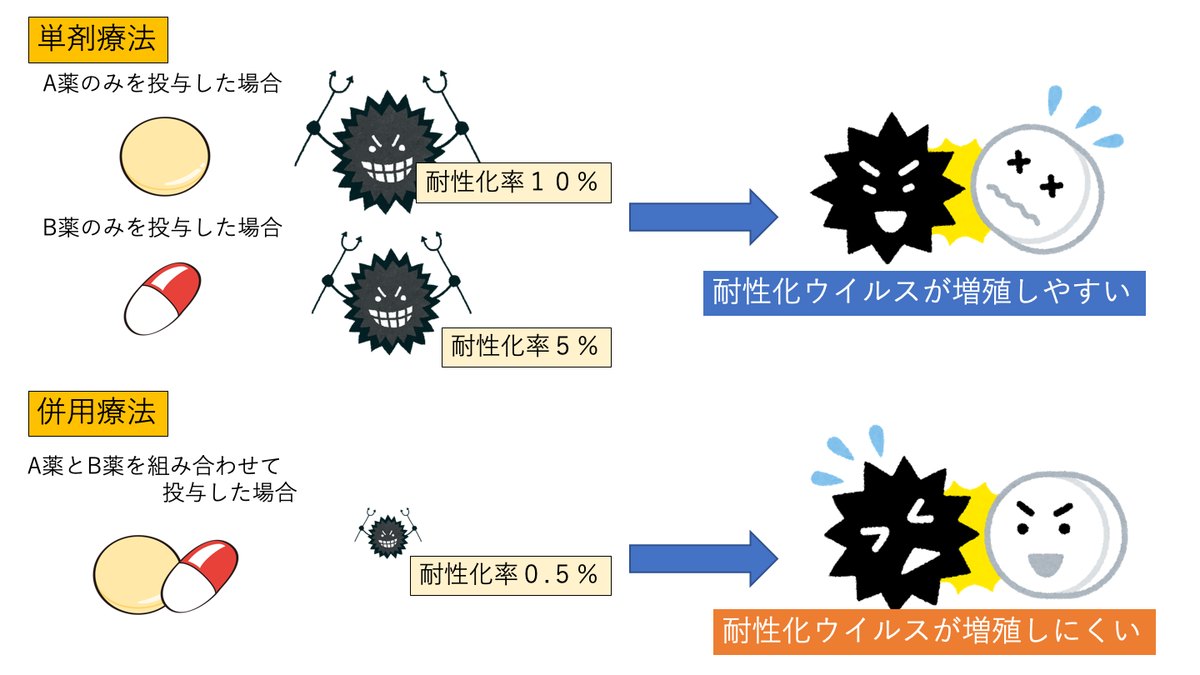
結核やC型肝炎など耐性が問題になる感染症では同じ理由での併用療法が用いられています。
現在使用されている薬剤
現在使用されている5種類の作用機序の薬剤についてまとめていきます。
- ヌクレオシド系逆転写酵素阻害剤(NRTI*14)
- 非ヌクレオシド系逆転写酵素阻害剤(NNRTI*15)
- プロテアーゼ阻害剤(PI*16)
- インテグラーゼ阻害剤(INSTI*17)
- 侵入阻害剤(CCR5阻害薬)
2018年には既治療のHIV感染症に対する2剤レジメン(2DR*18)配合薬 ジャルカ配合錠が登場、2020年1月には未治療HIV感染症、つまり治療開始時から使用できる2剤レジメン配合薬 ドウベイト配合錠が登場しており、生涯に渡って服薬を継続する必要のあるHIV感染症治療による身体への負担を軽減できる治療方法を選択することが可能となっています。
ヌクレオシド系逆転写酵素阻害剤(NRTI)
ヌクレオチド系逆転写酵素阻害剤(NtRTI*19)または核酸系逆転写酵素阻害剤とも呼ばれます。
ヌクレオシドに類似した構造を持っており、逆転写酵素がHIV RNAをHIV DNAに(逆)転写する際にヌクレオシドに紛れて取り込まれることで、転写反応を途中で停止させます。(増殖メカニズム③を阻害)

表が画面に入りきらない場合は横にスクロールできます。
| 一般名(略称)※配合の組み合わせ | 商品名 | 適応 | 承認 |
|---|---|---|---|
| ジドブジン(AZTまたはZDV) | レトロビルカプセル | HIV感染症 | 1987年11月 |
| ラミブジン(3TC) | エピビル錠 | HIV感染症 | 1997年2月 |
| ジドブジン/ラミブジン(AZT/3TCまたはCBV) | コンビビル錠 | HIV感染症 | 1999年6月 |
| アバカビル(ABC) | ザイアジェン錠 | HIV感染症 | 1999年9月 |
| テノホビル(TDF) | ビリアード錠 | HIV-1感染症 | 2004年4月 |
| アバカビル/ラミブジン(ABC/3TCまたはEPZ)※NRTI×2 | エプジコム配合錠 ラバミコム配合錠注1 | HIV感染症 | 2005年1月 2019年8月 |
| ドルテグラビル/アバカビル/ラミブジン (DTG/ABC/3TCまたはTRI)※INSTI/NRTI×2 | トリーメク配合錠 | HIV感染症 | 2015年3月 |
| エムトリシタビン(FTC) | エムトリバカプセル | HIV-1感染症 | 2005年4月 |
| テノホビル/エムトリシタビン(TDF/FTCまたはTVD)※NRTI×2 | ツルバダ配合錠 | HIV-1感染症 | 2005年4月 |
| リルピビリン/テノホビル/エムトリシタビン (RPV/TDF/FTCまたはCMP)※NNRTI/NRTI×2 | コムプレラ配合錠 | HIV-1感染症 | 2014年12月 |
| エルビテグラビル/エムトリシタビン/テノホビル/コビシスタット注2 (EVG/FTC/TDF/cobiまたはSTB)※INSTI/NRTI×2 | スタリビルド配合錠 | HIV-1感染症 | 2013年5月 |
| テノホビルアラフェナミド/エムトリシタビン (TAF/FTCまたはDVY)※NRTI×2 | デシコビ配合錠LT/デシコビ配合錠HT | HIV-1感染症 | 2016年12月 |
| リルピビリン/テノホビルアラフェナミド/エムトリシタビン (RPV/TAF/FTCまたはODF)※NNRTI/NRTI×2 | オデフシィ配合錠 | HIV-1感染症 | 2018年8月 |
| エルビテグラビル/コビシスタット注2/テノホビルアラフェナミド/エムトリシタビン (EVG/cobi/TAF/FTCまたはGEN)※INSTI/NRTI×2 | ゲンボイヤ配合錠 | HIV-1感染症 | 2016年6月 |
| ビクテグラビル/テノホビルアラフェナミド/エムトリシタビン (BIC/TAF/FTC)※INSTI/NRTI×2 | ビクタルビ配合錠 | HIV-1感染症 | 2019年3月 |
| ダルナビル/コビシスタット注2/エムトリシタビン/テノホビルアラフェナミド (D/C/F/TAF)※PI/NRTI×2 | シムツーザ配合錠 | HIV-1感染症 | 2019年6月 |
| ドルテグラビル/ラミブジン(DTG/3TC)※INSTI/NRTI | ドウベイト配合錠 | (未治療の)HIV-1感染症 | 2020年1月 |
注1:ジェネリック医薬品
注2:コビシスタットはブースターとして配合
ドウベイト配合錠は2剤レジメン(2DR)配合薬です。
非ヌクレオシド系逆転写酵素阻害剤(NNRTI)
非ヌクレオチド系逆転写酵素阻害剤または非核酸系逆転写酵素阻害剤とも呼ばれます。
NRTIと同様に逆転写酵素を阻害することでHIV RNAがHIV DNAに転写されるのを防ぎます。(増殖メカニズム③を阻害)

逆転写酵素を阻害するのはNRTIと同じですが、その作用機序は異なります。
NNRTIはその名前の通りヌクレオシドに類似した構造をしていません。
HIV逆転写酵素の活性中心に結合し、その立体構造を変化させることで酵素活性を阻害(アロステリック効果)します。

ただし、構造的にHIV-2には無効となっており、適応は「HIV-1感染症」となっています。
表が画面に入りきらない場合は横にスクロールできます。
| 一般名(略称) | 商品名 | 適応 | 承認 |
|---|---|---|---|
| ネビラピン(NVP) | ビラミューン錠 | HIV-1感染症 | 1998年12月 |
| エファビレンツ(EFV) | ストックリン錠注 | HIV-1感染症 | 1999年9月 |
| エトラビリン(ETR) | インテレンス錠 | (他の抗HIV薬に耐性が認められる)HIV-1感染症 | 2009年1月 |
| リルピビリン(RPV) | エジュラント錠 | (未治療の)HIV-1感染症 | 2012年5月 |
| リルピビリン/テノホビル/エムトリシタビン (RPV/TDF/FTCまたはCMP)※NNRTI/NRTI×2 | コムプレラ配合錠 | HIV-1感染症 | 2014年12月 |
| リルピビリン/テノホビルアラフェナミド/エムトリシタビン (RPV/TAF/FTCまたはODF)※NNRTI/NRTI×2 | オデフシィ配合錠 | HIV-1感染症 | 2018年8月 |
| ドルテグラビル/リルピビリン(DTG/RPV)※INSTI/NNRTI | ジャルカ配合錠 | (既治療の)HIV-1感染症 | 2018年11月 |
| ドラビリン(DOR) | ピフェルトロ錠 | HIV-1感染症 | 2020年1月 |
注:ストックリンカプセルは製造中止
ジャルカ配合錠は2剤レジメン(2DR)配合薬です。
プロテアーゼ阻害剤(PI)
HIVプロテアーゼは宿主細胞の転写・翻訳機能を利用してHIV RNAから作られたタンパク質を細かく切断し、HIVを構成するタンパク質を作り出す役割を持っています。
プロテアーゼ阻害剤はこの働きを阻害することで最終的に複製HIVウイルスが組み立てられるのを防ぎます。(増殖メカニズム⑨を阻害)

表が画面に入りきらない場合は横にスクロールできます。
| 一般名(略称) | 商品名 | 適応 | 承認 |
|---|---|---|---|
| ネルフィナビル(NFV) | ビラセプト錠 | HIV感染症 | 1998年3月 |
| リトナビル(RTV) | ノービア錠注1 | HIV感染症 | 1999年9月 |
| ロピナビル/少量リトナビル(LPV/r) | カレトラ配合錠/カレトラ配合内用液注2 | HIV感染症 | 2000年12月 |
| アタザナビル(ATV) | レイアタッツカプセル | HIV-1感染症 | 2004年1月 |
| ホスアンプレナビル(FPV) | レクシヴァ錠 | HIV感染症 | 2005年1月 |
| ダルナビル(DRV) | プリジスタ錠 プリジスタナイーブ錠 | (少なくとも1つのダルナビル耐性関連変異を持つ)HIV感染症 (未治療・ダルナビル耐性関連変異を持たない既治療)HIV感染症 | 2015年5月 2013年11月 |
| ダルナビル/コビシスタット注3 (DRV/cまたはPCX) | プレジコビックス配合錠 | HIV感染症 | 2016年11月 |
| ダルナビル/コビシスタット注3/エムトリシタビン/テノホビルアラフェナミド (D/C/F/TAF)※PI/NRTI×2 | シムツーザ配合錠 | HIV-1感染症 | 2019年6月 |
注1:ノービア・ソフトカプセル/ノービア・リキッド(ノービア内用液)は製造中止
注2:カレトラリキッドから名称変更
注3:コビシスタットはブースターとして配合
インテグラーゼ阻害剤(INSTI)
HIVインテグラーゼは宿主細胞のDNAを切断する働きを持っています。
切断されることで出来たヒトDNAの隙間にHIV DNAが入り込みます。
インテグラーゼ阻害剤はインテグラーゼの働きを抑制することによりHIV DNAが宿主DNAに組み込まれるのを防ぎ、HIV RNA(mRNA)が転写されるのを防ぎます。(増殖メカニズム⑤を阻害)

表が画面に入りきらない場合は横にスクロールできます。
| 一般名(略称) | 商品名 | 適応 | 承認 |
|---|---|---|---|
| ラルテグラビル(RAL) | アイセントレス400mg錠 アイセントレス600mg錠 | HIV感染症 | 2008年6月 2018年5月 |
| エルビテグラビル/エムトリシタビン/テノホビル/コビシスタット注 (EVG/FTC/TDF/cobiまたはSTB)※INSTI/NRTI×2 | スタリビルド配合錠 | HIV-1感染症 | 2013年5月 |
| エルビテグラビル/コビシスタット注/テノホビルアラフェナミド/エムトリシタビン (EVG/cobi/TAF/FTCまたはGEN)※INSTI/NRTI×2 | ゲンボイヤ配合錠 | HIV-1感染症 | 2016年6月 |
| ドルテグラビル(DTG) | テビケイ錠 | HIV感染症 | 2014年3月 |
| ドルテグラビル/アバカビル/ラミブジン (DTG/ABC/3TCまたはTRI)※INSTI/NRTI×2 | トリーメク配合錠 | HIV感染症 | 2015年3月 |
| ドルテグラビル/リルピビリン(DTG/RPV)※INSTI/NNRTI | ジャルカ配合錠 | (既治療の)HIV-1感染症 | 2018年11月 |
| ドルテグラビル/ラミブジン(DTG/3TC)※INSTI/NRTI | ドウベイト配合錠 | (未治療の)HIV感染症 | 2020年1月 |
| ビクテグラビル/テノホビルアラフェナミド/エムトリシタビン (BIC/TAF/FTC)※INSTI/NRTI×2 | ビクタルビ配合錠 | HIV-1感染症 | 2019年3月 |
注:コビシスタットはブースターとして配合
ジャルカ配合錠とドウベイト配合錠は2剤レジメン(2DR)配合薬です。
侵入阻害剤(CCR5阻害薬)
侵入阻止薬とも呼ばれます。
HIVはCD4細胞表面にあるCD4受容体に結合することで細胞内に侵入しますが、細胞内にHIVが侵入するためにはCD4受容体だけでなく、CCR5もしくはCXCR4にも結合する必要があります。
CCR5阻害剤はHIVがCCR5に結合することを阻害することでHIVがCD4細胞内に侵入するのを防ぎます。
C-Cケモカイン・レセプター5(CCR5*20、CD195)を阻害することでHIVがCD4細胞に侵入することを防ぎます。(増殖メカニズム①②を阻害)

表が画面に入りきらない場合は横にスクロールできます。
| 一般名(略称) | 商品名 | 適応 | 承認 |
|---|---|---|---|
| マラビロク(MVC) | シーエルセントリ錠 | CCR5指向性HIV-1感染症 | 2009年1月 |
現在開発中の薬剤
現在開発中の薬剤として長時間作用型の抗HIV薬の登場が期待されています。
現在、ヴィーブヘルスケアの長期作用型2DR配合注射薬(リルピビリンと新規INSTIカボテグラビル)が国内申請間近になっています。
月1回及び隔月投与(2ヶ月に1回)で標準的な3剤配合の経口剤と同等の効果が得られたということで、治療における患者負担を大幅に軽減できるのではないかと期待されています。
FDAでの審査が行われていましたが、2019年12月に承認が見送られています。
理由がはっきりしませんが、今後の展開に注目したいところです。
また、新規作用機序の薬剤として
- カプシド阻害剤(CAI*21)
があります。
カプシド阻害剤(CAI)
カプシド(capsid)とはカプソメアというタンパク質により構成されるウイルスゲノムを囲む殻です。
通常、ウイルスゲノムはカプシドにより分解酵素などから守られています。
ですが、ウイルスが宿主細胞に侵入するとカプシドが分解されゲノムが宿主細胞内に放出されます。
HIVウイルスの増殖過程においては侵入した際にカプシドは分解され、複製の最終段階でカプシドが合成されています。
HIV-1 カプシド阻害剤(CAI)はカプシドの調節機構を阻害することでHIVの増殖を多面的に抑制します。(増殖メカニズム②と⑩を阻害)

現在、ギリアドがGS- 6207という開発コードでCAIの開発を行っています。
申請・承認されれば、ファーストインクラスのカプシド阻害薬となります。
開発中の薬剤は他の抗HIV薬と配合した長時間作用型のものになるようです。
ヴィーブヘルスケアのものと同様、患者のQOLに貢献できる薬剤になりそうですね。
また、他の薬剤に対して耐性を持っているHIVに対しての大きな選択肢になりそうです。
参考資料・記事
抗HIV治療ガイドライン(2019年3月発行 7月27日改訂)ヒト免疫不全ウイルス(HIV)感染症(MSD マニュアル 家庭版)ヴィーブヘルスケア、長期作用型注射剤の 2 ヶ月に 1 回投与の 第III相臨床試験の結果を報告ギリアド・サイエンシズ、長時間作用型 HIV-1 治療薬の 構成成分となり得る新規 HIV-1 カプシド阻害剤GS-6207 のデータを発表
*1:Human Immunodeficiency Virus
*2:Acquired Immune Deficiency Syndrome
*3:Positive-sense Single-Stranded RNA
*4:PRotease
*5:Reverse Transcriptase
*6:INtegrase
*7:Nucleoside Analogue Reverse Transcriptase Inhibitor
*8:Non-Nucleoside Reverse Transcriptase Inhibitor
*9:Protease Inhibitor
*10:Integrase Strand Transfer Inhibitor
*11:CApsid Inhibitor
*12:Highly Active Anti-Retroviral Therapy
*13:Anti-Retroviral Therapy
*14:Nucleoside Analogue Reverse Transcriptase Inhibitor
*15:Non-Nucleoside Reverse Transcriptase Inhibitor
*16:Protease Inhibitor
*17:Integrase Strand Transfer Inhibitor
*18:2-Drug Regimen
*19:Nucleotide reverse transcriptase inhibitors
*20:C-C chemokine Receptor type 5
*21:CApsid Inhibitor








