エドルミズ錠はアナモレリン塩酸塩を有効成分とする薬剤で、がん悪液質に対する適応を有する初めての薬剤です。
スイス Helsinn Healthcare SAからライセンスを受けて小野薬品工業が日本での開発を担当、製造販売を行います。
(小野薬品工業は日本・韓国・台湾でアナモレリン塩酸塩を独占的に開発・商業化する権利を取得)
アナモレリンはグレリン様作用により生体内エネルギーを調整し、除脂肪体重(LBM:Lean Body Mass)や体重を増加させる効果を発揮します。
実際に処方された際、ここを押さえておけば大丈夫!という内容、その後に、さらに詳しく知りたい方への解説という形でまとめたいと思います。
目次を見れば処方監査と服薬指導のポイントがだいたい把握できる形にしているのでご参照ください。
- 1 エドルミズの服薬指導のポイント
- 1.1 警告記載あり
- 1.2 禁忌:心疾患・肝機能・消化管閉塞と併用禁忌に注意
- 1.3 効能・効果:非小細胞肺癌・胃癌・膵癌・大腸癌によるがん悪液質
- 1.4 用法・用量:1回2錠を空腹時に服用(起床時が望ましい)
- 1.5 慎重投与:心疾患全般、アントラサイクリン系薬剤の服用歴、肝機能障害、糖尿病に対する注意
- 1.6 相互作用:併用禁忌があるためCYP3A阻害薬には注意
- 1.7 妊娠中:有益性が危険性を上回る場合に投与
- 1.8 臨床成績:12週間の投与でLBMが有意に増加(ONO-7643-04試験)
- 1.9 作用機序:グレリン様作用により視床下部・脳下垂体のGHS-R1aを刺激して食欲亢進・体重増加
- 1.10 投与制限:2022年4月末までは14日分
- 2 そのほかの関連情報
- 3 参考資料
エドルミズの服薬指導のポイント
まずはエドルミズの処方監査・服薬指導の際に押さえておくべきポイントを整理します。
初めての投薬で不安な場合でも、ここを押さえておけば大丈夫!という内容で添付文書を読み解き解説します。
警告記載あり
エドルミズは警告が記載されている薬剤です。
この内容は薬局で何か注意するものではないのですが、医師が処方する際の注意点になるので、処方提案を行う際にはこの記載を念頭においておくべきです。
警告
本剤はがん悪液質の診断及び治療に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例にのみ投与すること。また、本剤投与開始に先立ち、患者又はその家族に本剤のベネフィット及びリスクを十分説明し、理解したことを確認した上で投与を開始すること。引用元:エドルミズ錠50mg 添付文書 小野薬品工業
エドルミズについては、世界初の薬剤ということに加えて、その効果(体重増加)の評価が難しい部分もあるため、安易に漫然と使用されることを防ぐためにこのような記載が追加されたものと思われます。
保険請求上の注意点については別にまとめます。
禁忌:心疾患・肝機能・消化管閉塞と併用禁忌に注意
「過敏症の既往歴」を除くと禁忌は以下の2〜7の6つです。
禁忌
2. うっ血性心不全のある患者〔心機能を抑制し、症状が悪化するおそれがある。〕
3. 心筋梗塞又は狭心症のある患者〔心機能を抑制し、症状が悪化するおそれがある。〕
4. 高度の刺激伝導系障害(完全房室ブロック等)のある患者〔本剤はナトリウムチャネル阻害作用を有するため、刺激伝導系に対し抑制的に作用し、悪化させるおそれがある。〕
5. 次の薬剤を投与中の患者:クラリスロマイシン、インジナビル、イトラコナゾール、ネルフィナビル、サキナビル、テラプレビル、ボリコナゾール、リトナビル含有製剤、コビシスタット含有製剤
6. 中等度以上の肝機能障害(Child-Pugh分類B及びC)のある患者〔本剤の体内からの消失には主に肝臓が寄与しているため、血中濃度が上昇し、刺激伝導系抑制があらわれるおそれがある。〕
7. 消化管閉塞等、消化管の器質的異常による食事の経口摂取が困難な患者引用元:エドルミズ錠50mg 添付文書 小野薬品工業
うっ血性心不全・心筋梗塞・狭心症・完全房室ブロック等の高度の刺激伝導系障害(2〜4)
エドルミズ(アナモレリン)はナトリウムチャネル阻害作用を持つため、「刺激伝導系抑制」が重大な副作用として記載されています。
重大な副作用
1. 刺激伝導系抑制(10.7%)
心電図異常(顕著なPR間隔又はQRS幅の延長、QTの延長等)、房室ブロック、頻脈、徐脈、動悸、血圧低下、上室性期外収縮等があらわれることがあるので、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。引用元:エドルミズ錠50mg 添付文書 小野薬品工業
このことからもわかるように、エドルミズ(アナモレリン)の投与により、うっ血性心不全、心筋梗塞、狭心症、高度の刺激伝導系障害(完全房室ブロック等)を悪化させ、重篤な症状を引き起こす可能性があるため禁忌となっています。
重要な基本的注意でも以下のように注意が求められています。
重要な基本的注意
1. 本剤はナトリウムチャネル阻害作用を有するため刺激伝導系に抑制的に作用する。本剤投与により心電図異常(顕著なPR間隔又はQRS幅の延長、QT間隔の延長等)があらわれることがあるので、本剤の投与開始前及び投与期間中は、心電図、脈拍、血圧、心胸比、電解質等を定期的に測定し、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。なお、本剤投与初期には特に注意すること。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
ここについてはまた後で詳しくまとめます。
中等度以上の肝機能障害(Child-Pugh分類B及びC)(6)
エドルミズ(アナモレリン)は、主に肝臓のCYP3A4により代謝を受けます。
また、放射線同位体(14C)で標識したアナモレリン塩酸塩25mgを単回経口投与した際、92〜93%が糞中、7〜8%が尿中に排泄されました。
このように、エドルミズ(アナモレリン)が体内から消失するにあたっては肝臓の働きが中心となっているため、中等度以上の肝機能傷害(Child-Pugh分類B及びC)を有する場合、血中濃度が上昇し、重大な副作用である「刺激伝導系の抑制」のリスクを高める可能性があるため禁忌となっています。
また、重大な副作用には「肝機能障害」も記載されているため、肝機能の更なる悪化を引き起こす可能性もあります。
参考:Child-Pugh(チャイルド・ピュー)分類について
Child-Pugh(チャイルド・ピュー)分類とは肝臓の障害度を表す分類です。
点数表を元にグレードの分類が行われます。
| グレード | 点数 | 肝障害の状態 |
|---|---|---|
| Grade A(軽度) | 5〜6点 | 代償性肝硬変 肝臓の機能が保たれた状態 |
| Grade B(中等度) | 7〜9点 | 代償性肝硬変から非代償性肝硬変への過渡期 軽度の合併症が見られる |
| Grade C(重度) | 10〜15点 | 非代償性肝硬変 肝臓の機能が維持できなくなり様々な合併症があらわれる |
以下の表の点数を元に分類を行います。
| 項目 | 1点 | 2点 | 3点 |
|---|---|---|---|
| 脳症 | ない | 軽度(Ⅰ、Ⅱ) | 時々昏睡(Ⅲ〜) |
| 腹水 | ない | 少量(1〜3L) | 中等量(3L〜) |
| 血清ビリルビン値(mg/dL) | 2.0未満 | 2.0〜3.0 | 3.0超 |
| 血清アルブミン値(g/dL) | 3.5超 | 2.8〜3.5 | 2.8未満 |
| プロトロンビン活性値(%) | 70超 | 40〜70 | 40未満 |
消化管閉塞等、消化管の基質異常により食事摂取が困難な場合(7)
エドルミズ(アナモレリン)はグレリン様作用により、視床下部や脳下垂体にあるグレリン受容体(GHS-R1a:Growth Hormone Secretagogue-Receptor 1a)を刺激することで効果を発揮します。
視床下部では食欲を亢進させ、脳下垂体では成長ホルモン(GH:Growth Hormone)の分泌を促して筋肉量を増加させます。
そのため、消化管閉塞等の消化管の基質的な異常による食事摂取減退に対しては効果を発揮することができず、消化管系の副作用等で症状を悪化させる可能性も否定できないため禁忌に設定されています。
併用禁忌:クラリスロマイシン、イトラコナゾール、ボリコナゾール、リトナビル、コビシスタット
アナモレリン塩酸塩25mgとケトコナゾール(強力なCYP3A4阻害剤)を併用した際、アナモレリン塩酸塩のCmaxは3.12倍、AUCinfは3.22倍に上昇しました。
そのため、強いCYP3A4阻害剤の併用は禁忌とされています。
各成分を含有する製品名(一般名表記を除く)をまとめます。
- クラリスロマイシン:クラリシッド、クラリス、ボノサップ、マインベース、ラベキュア
- イトラコナゾール:イトリゾール
- ボリコナゾール:ブイフェンド
- リトナビル:カレトラ、ノービア
- コビシスタット:ゲンボイヤ、シムツーザ、スタリビルド、プレジコビックス
インジナビル、ネルフィナビル、サキナビル、テラプレビルはすでに販売中止となっているため、保険診療上は国内で流通していません。(個人輸入等を除く)
- インジナビル:クリキシバン(販売中止:2018年3月31日をもって薬価削除)
- ネルフィナビル:ビラセプト(販売中止:2020年3月31日をもって薬価削除)
- サキナビル:インビラーゼ(販売中止:2018年3月31日をもって薬価削除)
- テラプレビル:テラビック(販売中止:2018年3月31日をもって薬価削除)
相互作用については後でもう少し詳しくまとめます。
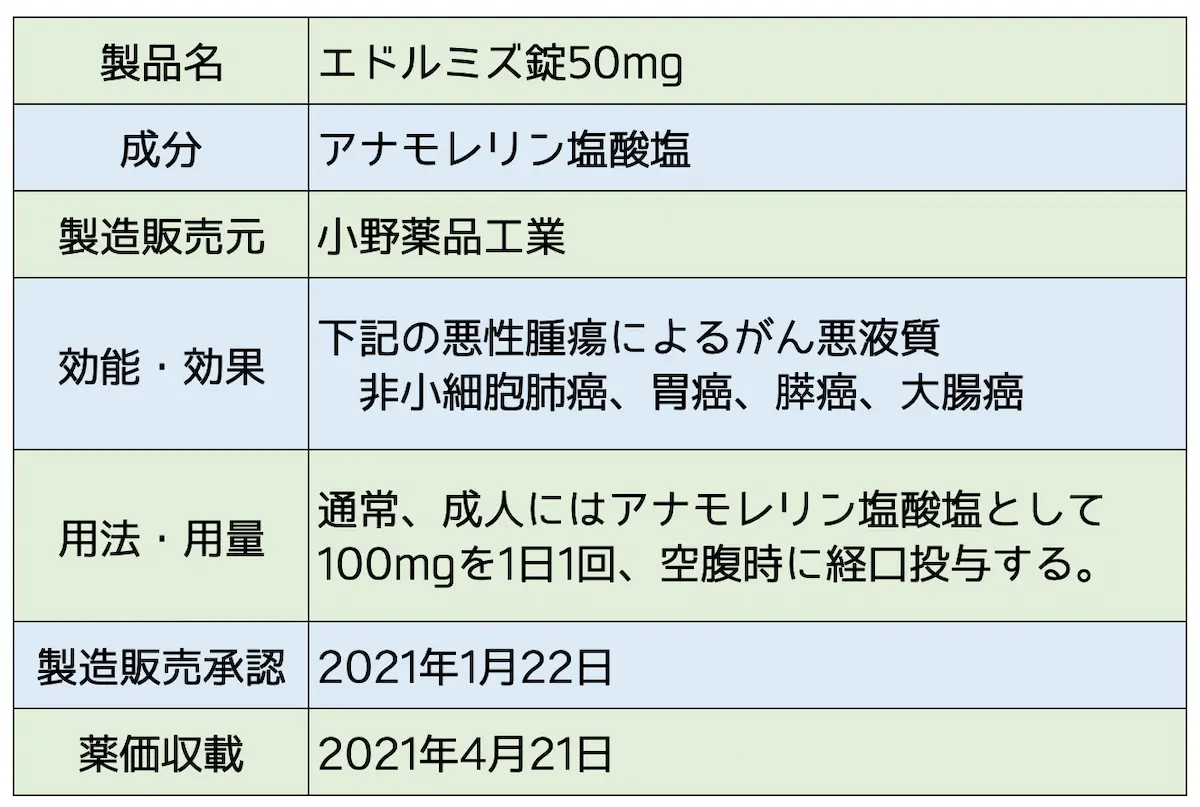
効能・効果:非小細胞肺癌・胃癌・膵癌・大腸癌によるがん悪液質
効能又は効果
下記の悪性腫瘍におけるがん悪液質
非小細胞肺癌、胃癌、膵癌、大腸癌引用元:エドルミズ錠50mg 添付文書 小野薬品工業
がん悪液質とは?
悪液質(カヘキシア)とはがんや慢性心不全、慢性腎不全、自己免疫疾患など様々な炎症性疾患により引き起こされる低栄養状態で、骨格筋の低下を特徴とする病態です。1)
悪液質は各種サイトカインを介する炎症反応の一種と考えられています。
炎症系サイトカインの放出が「食欲の抑制」、「骨格筋の減少」、「エネルギー消費の増加」を引き起こし、「食欲不振」と「体重減少」という悪液質の症状を形成しています。2)
1)悪液質(カヘキシア) -炎症を伴う疾患関連性低栄養- 現代医学67巻2号 令和2年12月(2020)
2)がん悪液質.jp 小野薬品工業
2011年に欧州のEuropean Palliative Care Research Collaborative(EPCRC)が公表したがん悪液質の診断基準は以下の3つのうちいずれかがある場合になっています。3)
- 過去6ヶ月間の体重減少>5%
- BMI<20、体重減少>2%
- サルコペニア、体重減少>2%
※サルコペニア:筋肉量の減少により筋力や身体機能が低下した状態
3) がん悪液質ハンドブック―「がん悪液質:機序と治療の進歩」を臨床に役立てるために
適応となるがん種:切除不能な進行・再発の非小細胞肺癌、胃癌、膵癌、大腸癌
効能又は効果に関連する使用上の注意
1. 切除不能な進行・再発の非小細胞肺癌、胃癌、膵癌、大腸癌のがん悪液質患者に使用すること。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
がん悪液質であれば使用可能というわけではなく、がん種が限られているため注意が必要です。
今後、適応が拡大され、より使いやすい薬剤になることが期待されます。
使用開始の条件:6ヵ月以内に5%以上の体重減少、食欲不振に加えて複数の症状の確認
栄養療法を行なっても効果が見られないケースに使用される薬剤ですが、使用開始に際しては詳しい条件が定められています。
効能又は効果に関連する使用上の注意
2. 栄養療法等で効果不十分ながん悪液質の患者に使用すること。
3. 6ヵ月以内に5%以上の体重減少と食欲不振があり、かつ以下の(1)〜(3)のうち2つ以上を認める患者に使用すること。
(1) 疲労又は倦怠感
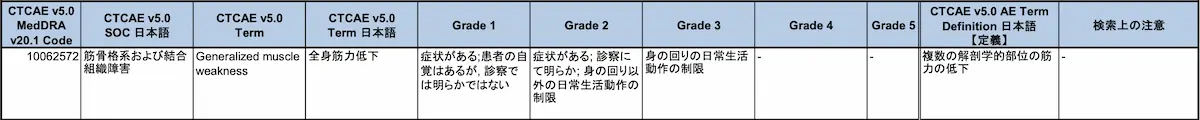
(2) 全身の筋力低下
(3) CRP値0.5mg/dL超、ヘモグロビン値12g/dL未満又はアルブミン値3.2g/dL未満のいずれか1つ以上
(参考)
(1)疲労又は倦怠感、(2)全身の筋力低下については、NCI Common Terminology Criteria for Adverse Events(CTCAE)日本語版JCOG訳を参考に評価を行い、Grade1以上を症状の目安とする。なお、筋力低下については、握力や歩行速度、椅子立ち上がりなどの指標も参考に評価を行うこと。引用元:エドルミズ錠50mg 添付文書 小野薬品工業
条件をまとめると以下のようになります。
- 6ヶ月以内に5%以上の体重減少および食欲不振
- 以下のうち2つ以上
- 疲労又は倦怠感(CTCAE Grade1以上)
- 全身の筋力低下(CTCAE Grade1以上)
- CRP>0.5mg/dL、Hb<12g/dL、Alb<3.2g/dLのいずれか1つ以上
投与を開始する際には以下のレセプトに「診断にあたって認められた症状」を記載することが求められています。
ちなみに、CTCAE Grade1の詳しいについては「Common Terminology Criteria for Adverse Events (CTCAE) version 5.0|JCOG」に掲載されています。
倦怠感

食事の傾向摂取が困難、食事の消化吸収不良の患者には使用しない
効能又は効果に関連する使用上の注意
4.食事の経口摂取が困難又は食事の消化吸収不良の患者には使用しないこと。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
禁忌と重なりますが、食事を摂ることができない場合は適応外です。
用法・用量:1回2錠を空腹時に服用(起床時が望ましい)
用法及び用量
通常、成人にはアナモレリン塩酸塩として100mgを1日1回、空腹時に経口投与する。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
1日1回、1回エドルミズ錠50mg 2錠を空腹時に服用します。
服用のタイミングは「起床時」で「服用後1時間は食事を摂らない」ことが望ましいと思いますがその理由は以下にまとめます。
空腹時(起床時)に服用し、1時間は食事をしない
空腹時に服用した後、1時間は食事をしないこととされています。
用法及び用量に関連する使用上の注意
1. 食事の影響を避けるため本剤は空腹時に服用し、本剤服用後1時間は食事をしないこと。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
詳しい理由は以下に記載されています。
薬物動態
2. 食事の影響
日本人健康成人(7例)に本剤50mgを空腹時、食事開始前1時間又は食事終了後2時間に単回経口投与した。食事開始前1時間に投与したときのアナモレリンのCmax及びAUC0-∞は、空腹時と比較してそれぞれ1.09及び0.80倍であり、臨床上問題となる影響は認められなかった。一方、食事終了後2時間に投与したときのアナモレリンのCmax及びAUC0-∞は、空腹時と比較してそれぞれ0.31及び0.49倍に低下し、食事の影響が認められた。
(注) 本剤の承認された用法・用量は「空腹時に1回100mgを1日1回経口投与」である。引用元:エドルミズ錠50mg 添付文書 小野薬品工業
食事終了後2時間でも吸収低下が著しい
ため、就寝前よりも起床時の服用が望ましいと思います。
服用開始後3週間で効果を確認する
エドルミズ錠は服用開始後3週間で効果を確認する必要があります。
用法及び用量に関連する使用上の注意
2. 本剤投与により体重増加又は食欲改善が認められない場合、投与開始3週後を目途に原則中止すること。
3. 12週間を超える本剤の投与経験はなく、体重、問診により食欲を確認する等、定期的に投与継続の必要性を検討すること。引用元:エドルミズ錠50mg 添付文書 小野薬品工業
また、12週間を超えて継続する場合を含めて、服用を継続するにあたっては定期的に投与継続の必要性を検討することが求められます。
これらについては医科のレセプトで「検討を行なった直近の年月日の記載」が求められています。
慎重投与:心疾患全般、アントラサイクリン系薬剤の服用歴、肝機能障害、糖尿病に対する注意
以下の通り、慎重投与の記載があります。
使用上の注意
慎重投与
1. 基礎心疾患(弁膜症、心筋症等)のある患者〔心機能を抑制し、症状が悪化するおそれがある。〕
2. 心筋梗塞又は狭心症の既往のある患者〔心機能を抑制し、症状が悪化するおそれがある。〕
3. 刺激伝導系障害(房室ブロック、洞房ブロック、脚ブロック等)のある患者〔本剤はナトリウムチャネル阻害作用を有するため、刺激伝導系に抑制的に作用し、悪化させるおそれがある。〕
4. QT間隔延長のおそれ又はその既往歴のある患者〔QT間隔延長が起こるおそれがある。〕
5. 電解質異常(低カリウム血症、低マグネシウム血症、低カルシウム血症)のある患者〔刺激伝導系抑制があらわれるおそれがある。〕
6. アントラサイクリン系薬剤の投与歴のある患者
7. 軽度の肝機能障害(Child-Pugh分類A)のある患者。軽度の肝機能障害のある患者が中程度のCYP3A4阻害剤を併用する場合は、特に注意すること。〔本剤の体内からの消失には主に肝臓が寄与しているため、血中濃度が上昇し、刺激伝導系抑制があらわれるおそれがある。また、中程度のCYP3A4阻害剤の併用により、本剤の代謝が阻害され、更に血中濃度が上昇するおそれがある。〕
8. 糖尿病患者〔血糖値を上昇させることがある。〕引用元:エドルミズ錠50mg 添付文書 小野薬品工業
重要な基本的注意と合わせて解説します。
心疾患に対する注意(1〜5):心電図、血圧・脈拍・胸部レントゲン撮影・血液検査(電解質)のチェックを!
エドルミズ(アナモレリン)はナトリウムチャネル阻害作用を有するため、基礎心疾患のある患者、心筋梗塞又は狭心症の既往のある患者、刺激伝導系障害のある患者、QT間隔延長のおそれ又はその既往歴のある患者、電解質異常のある患者では、重大な副作用に記載されているような「刺激伝導系抑制」を引き起こす可能性があるため注意喚起が行われています。
また、重要な基本的注意でも以下の通り注意喚起が行われています。
重要な基本的注意
1. 本剤はナトリウムチャネル阻害作用を有するため刺激伝導系に抑制的に作用する。本剤投与により心電図異常(顕著なPR間隔又はQRS幅の延長、QT間隔の延長等)があらわれることがあるので、本剤の投与開始前及び投与期間中は、心電図、脈拍、血圧、心胸比、電解質等を定期的に測定し、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。なお、本剤投与初期には特に注意すること。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
心電図、脈拍・血圧の確認、胸部レントゲン撮影(心胸比)、血液検査(電解質)の定期的な検査が行われているかどうかを定期的に確認
する必要があります。
投与初期は特に注意すると記載されていますが、国内臨床試験では投与初期(投与開始日〜投与14日目)で刺激伝導系抑制に関連する副作用の発現率が高くなっています。
アントラサイクリン系薬剤の服用歴→心毒性の副作用に注意(6)
アントラサイクリン系薬剤は蓄積性の心毒性を有するため生涯総投与量に注意が必要となっています。
そのため、過去の服用歴であっても、エドルミズ(アナモレリン)によるナトリウムチャネル阻害作用による「刺激伝導系抑制」の影響を受ける可能性があります。
アントラサイクリン系薬剤とその製品名(一般名表記を除く)をまとめます。
- ドキソルビシン塩酸塩
- アドリアシン
- ドキシル
- ダウノルビシン塩酸塩
- ダウノマイシン
- エピルビシン塩酸塩
- ファルモルビシン
- アクラルビシン塩酸塩
- アクラシノン
- イダルビシン塩酸塩
- イダマイシン
- ピラルビシン塩酸塩
- テラルビシン
- ピノルビン
- アムルビシン塩酸塩
- カルセド
相互作用については後で詳しくまとめます。
軽度の肝機能障害→副作用の発現に注意(7)
エドルミズ(アナモレリン)が体内から消失するにあたっては肝臓の働きが中心となっているため、中等度以上の肝機能障害(Child-Pugh分類B及びC)は禁忌とされています。
そのため、軽度の肝機能障害(Child-Pugh分類A)であっても血中濃度が上昇する可能性は否定できず、副作用発現に注意が必要です。
特に、中程度のCYP3A4阻害薬を併用する際にはその影響が大きくなる可能性があります。
また、重大な副作用には「肝機能障害」も記載されているため、肝機能の更なる悪化を引き起こす可能性もあります。
重要な基本的注意には以下のように記載されています。
重要な基本的注意
3. 肝機能障害があらわれることがあるので、本剤の投与開始前及び投与期間中は定期的に肝機能検査を行うこと。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
糖尿病患者→血糖値上昇に注意(8)
重大な副作用に「高血糖、糖尿病の悪化」が記載されています。
エドルミズ(アナモレリン)はグレリン様作用薬により食欲増進を引き起こし、食事摂取量を増加させるため当然ではあるのですが、急激な変化を引き起こす可能性があるので注意が必要です。
重要な基本的注意には以下のように記載されています。
重要な基本的注意
2. 高血糖があらわれることがあるので、本剤の投与開始前及び投与期間中は定期的に血糖値や尿糖の測定を行うこと。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
糖尿病であれば定期的に血糖値測定は行われていると思います。
相互作用:併用禁忌があるためCYP3A阻害薬には注意
相互作用は意外と多いです。
特に併用禁忌であるCYP3A4阻害薬の併用とと併用注意ではありますがアントラサイクリン系薬剤の併用を含めた服用歴には注意が必要と思います。
併用禁忌:クラリスロマイシン、イトラコナゾール、ボリコナゾール、リトナビル、コビシスタット
禁忌の項でも触れましたが、併用禁忌が多く存在します。
全て強力なCYP3A4阻害薬です。
併用禁忌
薬剤名等:
クラリスロマイシン(クラリシッド)
インジナビル(クリキシバン)
イトラコナゾール(イトリゾール)
ネルフィナビル(ビラセプト)
サキナビル(インビラーゼ)
テラプレビル(テラビック)
ボリコナゾール(ブイフェンド)
リトナビル含有製剤(ノービア)
コビシスタット含有製剤(スタリビルド)臨床症状・措置方法:本剤の血中濃度が上昇し、副作用の発現が増強されるおそれがある。
機序・危険因子:これらの薬剤のCYP3A4に対する強い阻害作用により、本剤の代謝が阻害される
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
インジナビル(クリキシバン)、ネルフィナビル(ビラセプト)、サキナビル(インビラーゼ)、テラプレビル(テラビック)は日本ではすでに販売中止となっているので、クラリスロマイシン(クラリシッド)、インジナビル(クリキシバン)、イトラコナゾール(イトリゾール)、ボリコナゾール(ブイフェンド)、リトナビル含有製剤(ノービア)、コビシスタット含有製剤(スタリビルド)との併用を避ける必要があります。
各成分を含有する製品名(一般名表記を除く)は以下の通りです。
- クラリスロマイシン:クラリシッド、クラリス、ボノサップ、マインベース、ラベキュア
- イトラコナゾール:イトリゾール
- ボリコナゾール:ブイフェンド
- リトナビル:カレトラ、ノービア
- コビシスタット:ゲンボイヤ、シムツーザ、スタリビルド、プレジコビックス
併用注意:心機能に影響を与える薬剤
エドルミズ(アナモレリン)はナトリウムチャネル阻害作用による陰性変力作用と変伝導作用を有するため、以下の通り併用注意が記載されています。
併用注意
薬剤名等:抗不整脈薬(ピルシカイニド塩酸塩水和物等)
臨床症状・措置方法:これらの薬剤の催不整脈作用が増強されるおそれがある。
機序・危険因子:本剤はナトリウムチャネル阻害作用を有するため、これらの薬剤との併用により、催不整脈作用が増強される可能性がある。薬剤名等:β遮断剤(アテノロール等)
臨床症状・措置方法:過度の心機能抑制作用があらわれることがある。
機序・危険因子:両剤の陰性変力作用と変伝導作用により相互に心機能抑制作用を増強するおそれがある。薬剤名等:心毒性を有する抗悪性腫瘍剤(アントラサイクリン系薬剤等)
臨床症状・措置方法:これらの薬剤の心毒性が増強されるおそれがある。
機序・危険因子:本剤はナトリウムチャネル阻害作用を有するため、これらの薬剤との併用により、心毒性が増強される可能性がある。薬剤名等:QT間隔延長を起こすことが知られている薬剤(イミプラミン、ピモジド等)
臨床症状・措置方法:QT間隔延長、心室性不整脈(Torsade de pointesを含む)等の重篤な副作用を起こすおそれがある。
機序・危険因子:本剤の刺激伝導系抑制作用により、これらの薬剤のQT間隔延長作用が増強するおそれがある。引用元:エドルミズ錠50mg 添付文書 小野薬品工業
いずれにしても心機能に関する副作用発現に注意な薬剤ということです。
併用注意:CYP3A4を介した相互作用
エドルミズ(アナモレリン)は主にCYP3A4により代謝されるため、CYP3A4を阻害・誘導する薬剤との併用は注意が必要です。
併用注意
薬剤名等:中程度のCYP3A4阻害剤(エリスロマイシン、ジルチアゼム、ホスアンプレナビル、イマチニブ等)
臨床症状・措置方法:本剤の血中濃度が上昇し、副作用の発現が増強されるおそれがある。
機序・危険因子:これらの薬剤のCYP3A4に対する阻害作用により、本剤の代謝が阻害される。薬剤名等:グレープフルーツジュース
臨床症状・措置方法:本剤の血中濃度が上昇し、副作用の発現が増強されるおそれがある。
機序・危険因子:グレープフルーツジュースに含まれる成分のCYP3A4に対する阻害作用により、本剤の代謝が阻害される。薬剤名等:CYP3A4誘導剤(カルバマゼピン、リファンピシン、フェニトイン、セイヨウオトギリソウ(St. John’s Wort:セント・ジョーンズ・ワート)含有食品等)
臨床症状・措置方法:本剤の血中濃度が低下し、効果が減弱するおそれがある。
機序・危険因子:これらの薬剤のCYP3A4に対する誘導作用により、本剤の代謝が促進される。引用元:エドルミズ錠50mg 添付文書 小野薬品工業
CYP3A4阻害については肝機能障害と合わさることで影響が大きくなるので、あわせて注意する必要があります。
妊娠中:有益性が危険性を上回る場合に投与
妊娠中の安全性は確立されておらず、「有益性が危険性を上回る場合にのみ投与」の記載となっています。
妊婦、産婦、授乳婦等への投与
1. 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。〔マウスへのグレリンあるいはグレリンアナログの投与により胚発生の遅延、胎児体重の低値、妊娠率の低下、胎児数の減少が認められている。また、本剤の胎盤通過性は不明であるが、脂溶性が高いこと、弱塩基性であること等を考慮すると、胎盤を通過する可能性がある。〕
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
マウスで妊娠率の低下、胎児数の減少が認められています。
胎盤通過性は不明ですが、脂溶性の高さ・弱塩基性の性質から胎盤を通過する可能性があると考えられます。
授乳中:治療上の有益性と母乳栄養の有益性を考慮して判断
授乳中の投与については明確な答えはありませんが、乳汁中に移行した場合に危険性があるという証拠もないようです。
妊婦、産婦、授乳婦等への投与
2. 授乳婦には治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。〔本剤の乳汁中への移行は不明であるが、脂溶性が高いこと、弱塩基性であること等を考慮すると、乳汁中に移行する可能性がある。〕
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
そのため、治療上の有益性及び母乳栄養の有益性を考慮して判断するという結論になっています。
高齢者:投与:投与可能
高齢者への投与
一般に高齢者では生理機能(腎機能、肝機能、免疫機能等)が低下しているので、患者の状態を観察しながら慎重に投与すること。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
高齢者に対しての投与は可能だが生理機能の低下に伴う注意は必要です。
他の多くの薬剤と同じですね。
小児等:不明
小児等への投与
小児等に対する臨床試験は実施していない。
引用元:エドルミズ錠50mg 添付文書 小野薬品工業
小児等に対する試験は行われていないため、データがない状態です。
臨床成績:12週間の投与でLBMが有意に増加(ONO-7643-04試験)
主要評価項目を12週時点の「除脂肪体重(LBM)のベースラインから変化」とした国内臨床試験(ONO-7643-04試験)のデータが掲載されています。
治療期第3週からプラセボ群と比較して有意な増加が認められ、それは12週間の投与期間中維持されています。
副次評価項目:体重・食欲が有意に増加(ONO-7643-04試験)
副次評価項目である体重の変化についても、治療期第1週から有位に増加しています。
同じく副次評価項目である食欲関連項目スコアについても治療期第1週から有位に増加しています。
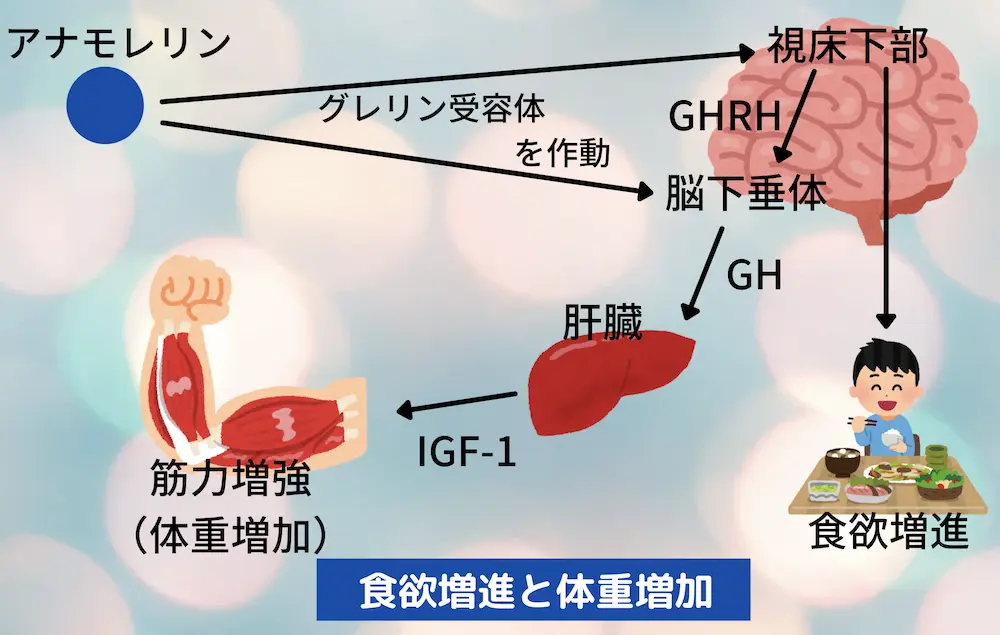
作用機序:グレリン様作用により視床下部・脳下垂体のGHS-R1aを刺激して食欲亢進・体重増加
エドルミズ(アナモレリン)の作用機序は以下の通りです。
薬効薬理
1. 作用機序
本剤は、グレリン受容体であるGHS-R1a(成長ホルモン放出促進因子受容体タイプ1a)に対する作動作用を有する。本剤は、GHS-R1aの活性化を介して成長ホルモン(GH)の分泌を促進し食欲を亢進することで、体重を増加させる。
2. 薬理作用
(1) 本剤は、組換え型ヒトGHS-R1aに結合し、ラット下垂体細胞に作用してGHの分泌を促進した(in vitro)。
(2) 本剤は、ラットへの単回経口投与で血漿中GH濃度を増加させた。
(3) 本剤は、ラットへの反復経口投与で摂餌量及び体重を増加させた。引用元:エドルミズ錠50mg 添付文書 小野薬品工業
エドルミズ(アナモレリン)はグレリン様作用により、視床下部や脳下垂体にあるグレリン受容体(GHS-R1a:Growth Hormone Secretagogue-Receptor 1a)を刺激することで効果を発揮します。
視床下部では食欲を亢進させ、脳下垂体では成長ホルモン(GH:Growth Hormone)の分泌を促します。
また、視床下部では成長ホルモン放出ホルモン(GHRH:Growth Hormone-Releasing Hormone)を分泌させることで、脳下垂体からのGHの分泌を促進します。
GHは肝臓でインスリン様成長因子-1(IGF-1:Insulin-like Growth Factors-1、ソマトメジン)を分泌させ、IGF-1が筋肉の蛋白質合成を促進し、筋肉量を増加させます。
投与制限:2022年4月末までは14日分
エドルミズ錠は新医薬品に該当するため、厚生労働省告示第97号(平成20年3月19日付)に基づき、2022年4月末日までは、投薬は1回14日分が限度とされています。
そのほかの関連情報
ここからは服薬指導にはいらないかもしれないけど、知っておきたい情報をまとめます。
承認までの経緯
エドルミズ錠(アナモレリン)は世界初のがん悪液質治療薬です。
これまで世界でもがん悪液質の治療薬の開発が行われてきましたが、主要評価項目である除脂肪体重(筋肉量)の変化を評価する意義についての考え方などがまとまらず開発失敗となったものも存在します。
実際、エドルミズ錠も2019年8月29日の薬事・食品衛生審議会医薬品第一部会(薬食審・医薬品第一部会)で審議されましたが、承認は了承されず継続審議となりました。
その後、1回目の審議で出された質問の回答を取りまとめ、2020年12月11日の薬食審・医薬品第一部会で再審議の上、承認了承となりました。
1回目の審議では「がん悪液質」を適応としていましたが、2回目の審議では適応を絞って「非小細胞肺がん、胃がん、膵がん、大腸がんのがん悪液質」とし、警告欄などでの注意喚起を加えることで承認が認められました。
その後、2021年1月22日に製造販売が承認されています。
このような経緯もあり、小野薬品工業はエドルミズ錠50mgの適正使用に関するお願い|小野薬品工業(2021年1月22日 策定)を公開して注意喚起を行なっています。
命名の由来
エドルミズの英語表記はadlumiz。
体重増加(Add)、光を照らす(Illuminate)を連想させることから命名されてます。
一般名アナモレリンのステム「-morelin」は成長ホルモン放出促進ペプチドを指します。
レセプト(医科)上の注意
使用薬剤の薬価(薬価基準)の一部改正等について(保医発0420第3号 令和3年4月20日)
4 薬価基準の一部改正に伴う留意事項について
(2) エドルミズ錠 50mg
① 本製剤の効能又は効果に関連する使用上の注意において、「切除不能な進行・再発の非小細胞肺癌、胃癌、膵癌、大腸癌のがん悪液質患者に使用すること。」、「栄養療法等で効果不十分ながん悪液質の患者に使用すること。」及び「食事の経口摂取が困難又は食事の消化吸収不良の患者には使用しないこと。」とされているので、使用に当たっては十分留意すること。
② 本製剤の効能又は効果に関連する使用上の注意において、以下のアに該当し、イ〜エのうち2つ以上を認める患者に使用することとされているため、投与開始に当たっては、診療報酬明細書の摘要欄に以下のア〜エのうち該当するものをすべて記載すること。
ア 6ヵ月以内での5%以上の体重減少及び食欲不振
イ 疲労又は倦怠感
ウ 全身の筋力低下
エ CRP値0.5mg/dL超、ヘモグロビン値12g/dL未満又はアルブミン値3.2g/dL未満のいずれか 1 つ以上
なお、「イ 疲労又は倦怠感」及び「ウ 全身の筋力低下」については、NCI Common Terminology Criteria for Adverse Events (CTCAE) 日本語版JCOG訳を参考に評価を行い、Grade1以上を症状の目安とすること。また、筋力低下については、握力や歩行速度、椅子立ち上がりなどの指標も参考に評価を行うこと。
③ 本製剤の用法・用量に関連する使用上の注意において、「本剤投与により体重増加又は食欲改善が認められない場合、投与開始3週後を目途に原則中止すること。」及び「12週間を超える本剤の投与経験はなく、体重、問診により食欲を確認する等、定期的に投与継続の必要性を検討すること。」とされているので、投与継続の検討を行った直近の年月日を記載すること。引用元:使用薬剤の薬価(薬価基準)の一部改正等について(保医発0420第3号 令和3年4月20日)
処方する際にはレセプトの摘要欄に複数の記載が必要となっています。
- 投与開始(②)の際には、「効能又は効果に関連する使用上の注意」に記載されている適応の条件をレセプト摘要等に記載
- (3週間以上の)投与を継続(③)する際には「投与継続の検討を行なった直近の年月日」をレセプト適用欄に記載
保険請求上、かなり厳格な管理が必要とされる薬剤となっているので注意が必要ですね。
日本がんサポーティブケア学会からの適正使用情報
アナモレリン(商品名 エドルミズ錠®)の適正使用について|日本がんサポーティブケア学会
アナモレリン(商品名 エドルミズ錠®)の適正使用について 2021-06-15
がん悪液質を適応とした初の薬剤であるアナモレリン(商品名 エドルミズ錠®)が上市されました。
適応となるがんは非小細胞肺がん、胃がん、膵臓がん、大腸がんの4がん種に限定されていますが、
がん悪液質の患者さんには大きな恩恵になると思います。アナモレリンの適正使用に関して、上記小野薬品工業株式会社からの文書に加えてCachexia部会よりコメントさせていただきます。
同剤の治験ではECOG PS(Performance Status)PS3-4の患者さんは除外されており、全身状態不良の方における有効性、安全性のエビデンスは十分ではありませんので、処方される場合はその点に留意いただく必要があります。
また、浮腫や体腔液貯留のある方は通常の体重測定により除脂肪体重の推移を評価することが難しく、同剤の投与は慎重にご判断ください。
その他、添付文書の記載内容をご確認の上、適正使用に心がけていただきたいと思います。がん悪液質の診断や治療については、今後当学会Cachexia部会を中心に診療の手引書を作成予定です。
「ECOG PS(Performance Status)PS3-4の患者さんは除外」とありますが、ECOG のPerformance Status(PS)の日本語訳|JCOG(日本臨床腫瘍研究グループ)によると、
- PS3:限られた自分の身の回りのことしかできない。日中の50%以上をベッドか椅子で過ごす。
- PS4:全く動けない。 自分の身の回りのことは全くできない。完全にベッドか椅子で過ごす。
と定義されています。
「浮腫や体腔液貯留のある方は通常の体重測定により除脂肪体重の推移を評価することが難しく」についても配慮しないといけない部分ですね。
薬価は原価計算方式で算定
エドルミズ錠50mgは新規作用機序・初の適応ということで、原価計算方式で算定されています。
エドルミズ錠50mg:246.40円/錠(2021年4月21日 薬価収載)
- 製品総原価:176.50円
- 営業利益:30.70円(流通経費を除く価格の14.8%)
- 流通経費:16.80円(消費税を除く価格の7.5%)
- 消費税:22.40円
RMP(医薬品リスク管理計画書)
- 重要な特例されたリスク
- 高血糖
- 肝機能障害
- 刺激伝導性抑制
- 重要な潜在的リスク
- 腫瘍憎悪
- 中程度のCYP3A4阻害剤との相互作用
ほとんどの項目が添付文書内で触れられたものなので説明は省きます。
腫瘍憎悪(重要な潜在的リスク)についてですが、マウスを用いた実験で否定されています。
ただし、エドルミズ(アナモレリン)投与によりGHの分泌が促進された結果として上昇するIGF-1(ソマトメジン)が腫瘍を増殖させる可能性は否定できないため、重要な潜在的リスクとして掲載されています。
参考資料
この記事を作成するにあたって参考にした資料・ホームページの一覧です。
- エドルミズ錠50mg 添付文書 小野薬品工業
- エドルミズ錠50mg インタビューフォーム 添付文書 小野薬品工業
- エドルミズ錠50mgに係る医薬品リスク管理計画書(RMP) 小野薬品工業
- エドルミズ錠50mg 審議結果報告書
- 悪液質(カヘキシア) -炎症を伴う疾患関連性低栄養- 現代医学67巻2号 令和2年12月(2020)
- がん悪液質.jp 小野薬品工業
- がん悪液質ハンドブック―「がん悪液質:機序と治療の進歩」を臨床に役立てるために
- Common Terminology Criteria for Adverse Events (CTCAE) version 5.0|JCOG
- エドルミズ錠50mgの適正使用に関するお願い|小野薬品工業(2021年1月22日 策定)
- 使用薬剤の薬価(薬価基準)の一部改正等について(保医発0420第3号 令和3年4月20日)
- アナモレリン(商品名 エドルミズ錠®)の適正使用について|日本がんサポーティブケア学会
- ECOG のPerformance Status(PS)の日本語訳|JCOG(日本臨床腫瘍研究グループ)