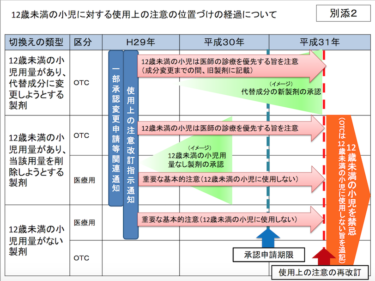
平成29年7月4日、厚生労働省医薬・生活衛生局は、新たな副作用が確認された医薬品について、添付文書の使用上の注意を改訂するよう日本製薬団体連合会に通知しました。
今回注目されたのはコデインリン酸塩含有製剤並びにジヒドロコデインリン酸塩含有製剤及びトラマドール塩酸塩含有製剤の小児への投与についてです。
ですが、それ以外にも、ロキソニン外用剤によるショック・アナフィラキシー、オプジーボによる硬化性胆管炎などの追記があります。
今回は、コデイン・トラマドール以外の改訂内容についてまとめてみます。
※副作用に関する記載を中心とした記事ですが、あくまでも医療従事者を対象とした記事です。副作用の追加=危険な薬剤というわけではないのがほとんどです。服用に際して自己判断を行わず医療従事者の指示にしたがってください。
使用上の注意の改訂指示(平成29年7月4日)
PMDAへのリンクを貼っておきます。
ロキソプロフェンナトリウム水和物(外皮用剤)によるショック・アナフィラキシー
添付文書改訂の対象となる商品名は以下のとおりです。
- ロキソニンパップ100mg
- ロキソプロフェンNaパップ100mg(各社)
- ロキソプロフェンナトリウムパップ100mg(各社)
- ロキソプロフェンNaパップ200mg「三笠」
- ロキソニンテープ100mg
- ロキソプロフェンNaテープ100mg(各社)
- ロキソプロフェンナトリウムテープ100mg(各社)
- ロキソニンテープ50mg
- ロキソプロフェンNaテープ50mg(各社)
- ロキソプロフェンナトリウムテープ50mg(各社)
- ロキソニンゲル1%
- ロキソプロフェンNaゲル1%(各社)
- ロキソプロフェンNa外用ポンプスプレー1%(各社)
ロキソプロフェンナトリウム水和物(外皮用剤)の添付文書改訂内容
添付文書の「副作用」の項に「重大な副作用」として以下の内容が追記されます。
「ショック、アナフィラキシー:ショック、アナフィラキシー(血圧低下、蕁麻疹、喉頭浮腫、呼吸困難等)があらわれることがあるので、観察を十分に行い、異常が認められた場合には直ちに使用を中止し、適切な処置を行うこと。」
症例報告
直近3年度の国内副作用症例の集積状況で、ショック、アナフィラキシー関連症例が6件報告されています。
そのうち、因果関係が否定できない症例は2例です。
死亡例については報告されていません。
要指導医薬品:ロキソプロフェンナトリウム水和物(外皮用剤)にも同様の改訂指示
OTC(要指導医薬品)といて販売されているロキソプロフェンナトリウム水和物(外皮用剤)についても同様に使用上の注意の改訂指示が出されています。
OTCロキソプロフェンナトリウム水和物(外皮用剤)の添付文書改訂内容
添付文書の「相談すること」の項に下線部の内容が追記されます。
使用後、次の症状があらわれた場合は副作用の可能性があるので、直ちに使用を中止し、この文書を持って医師又は薬剤師に相談すること
まれに下記の重篤な症状が起こることがある。その場合は直ちに医師の診療を受けること。
ショック(アナフィラキシー):使用後すぐに、皮膚のかゆみ、じんましん、声のかすれ、くしゃみ、のどのかゆみ、息苦しさ、動悸、意識の混濁等があらわれる。
ヒドロキソコバラミンによる急性腎障害
添付文書改訂の対象となる商品名は以下のとおりです。
- シアノキット注射用5gセット
ヒドロキソコバラミンの添付文書改訂内容
添付文書の「副作用」の項に「重大な副作用」として以下の内容が追記されます。
急性腎障害:急性腎障害があらわれることがあり、腎尿細管壊死が認められた症例も報告されている。観察を十分に行い、異常が認められた場合には適切な処置を行うこと。
症例報告
直近3年度の国内副作用症例の集積状況で、急性腎障害関連症例が2件報告されています。
因果関係が否定できない症例はなく、死亡例についても報告されていません。
ですが、国内症例・海外症例が集積し、CCDS(Company Core Data Sheet:企業中核データシート)が改訂されたことから、添付文書の改訂が適切と判断されたようです。
ニボルマブ(遺伝子組換え)による硬化性胆管炎
添付文書改訂の対象となる商品名は以下のとおりです。
- オプジーボ点滴静注20mg
- オプジーボ点滴静注100mg
ニボルマブ(遺伝子組換え)の添付文書改訂内容
添付文書の「副作用」の「重大な副作用」の項の肝機能障害、肝炎に関する記載に下線部が追記されます。
肝機能障害、肝炎、硬化性胆管炎:AST(GOT)増加、ALT(GPT)増加、γ-GTP増加、Al-P増加、ビリルビン増加等を伴う肝機能障害、肝炎、硬化性胆管炎があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど、適切な処置を行うこと。
症例報告
直近3年度の国内副作用症例の集積状況で、硬化性胆管炎関連症例が10件報告されています。
そのうち、因果関係が否定できない症例は6例です。
死亡例について1例報告されていますが、因果関係が否定できないものではありませんでした。
フルコナゾール、ホスフルコナゾールによる薬剤性過敏症症候群
添付文書改訂の対象となる商品名は以下のとおりです。
フルコナゾール
- ジフルカンカプセル50mg
- ジフルカンカプセル100mg
- フルコナゾールカプセル50mg (各社)
- フルコナゾールカプセル100mg(各社)
- ジフルカンドライシロップ350mg
- ジフルカンドライシロップ1400mg
- ジフルカン静注液50mg
- ジフルカン静注液100mg
- ジフルカン静注液200mg
- フルコナゾール静注50mg(各社)
- フルコナゾール静注100mg(各社)
- フルコナゾール静注200mg (各社)
- フルコナゾール静注液50mg(各社)
- フルコナゾール静注液100mg(各社)
- フルコナゾール静注液200mg(各社)
- フルコナゾール静注液0.1%「F」
- フルコナゾール静注液0.2%「F」(50mL)
- フルコナゾール静注液0.2%「F」(100mL)
ホスフルコナゾール
- プロジフ静注液100
- プロジフ静注液200
- プロジフ静注液400
フルコナゾール、ホスフルコナゾールの添付文書改訂内容
添付文書の「副作用」の「重大な副作用」の項に以下の内容が追記されます。
薬剤性過敏症症候群:初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には投与を中止し、適切な処置を行うこと。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
症例報告
まず、フルコナゾール。
直近3年度の国内副作用症例の集積状況で、薬剤性過敏症症候群関連症例が2件報告されています。
そのうち、因果関係が否定できない症例は1例です。
死亡例については報告されていません。
次に、ホスフルコナゾール。
直近3年度の国内副作用症例の集積状況で、薬剤性過敏症症候群関連症例が1件報告されています。
そのうち、因果関係が否定できない症例はなく、死亡例についても報告されていません。
金チオ硫酸ナトリウムを含有するパッチテスト用薬による遅発陽性反応
添付文書改訂の対象となる商品名は以下のとおりです。
- パッチテストパネル(S)
パッチテストパネル(S)の添付文書改訂内容
添付文書の「重要な基本的注意」の項の遅発陽性反応に関する記載に下線部が追記されます。
遅発陽性反応が検査7~10日後に発現することがあり、金チオ硫酸ナトリウムについては、検査20日以上経過してから遅発陽性反応が発現したとの報告もある。
また、下記の文章が追記されます。
パッチテスト実施前には、感作や遅発陽性反応が生じる可能性があることを患者に説明し、判定後に陽性反応が発現した場合は、速やかに医療機関を受診するように注意を促すこと。
症例報告
直近3年度の国内副作用症例の集積状況で、金チオ硫酸ナトリウムに対する感作関連症例が7件報告されています。
そのうち、因果関係が否定できない症例は4例です。
死亡例については報告されていません。